Schematische Darstellung des Lebenszyklus von Plasmodium sp.
Diese Kapitel beschreibt die verschiedenen Stadien im Menschen und der Anophelesmücke der Malariaparasiten anhand von Plasmodium falciparum und Plasmodium vivax.
6.1. Geschlechtliche Entwicklung
in der Anophelesmücke
- 6.1.1. Weibliche Makrogameten und männliche
Mikrogameten
-- 6.1.1.1. Gametogenesis
--- 6.1.1.1.1. Makrogametogenesis
--- 6.1.1.1.2. Mikrogametogenesis
-- 6.1.1.2. Abhängigkeit
der Infektionsrate
--- 6.1.1.2.1. Vom
Zwischenwirt bestimmte Faktoren
---
6.1.1.2.2. Von der Interaktion zwischen Parasit und Zwischenwirt bestimmte
Faktoren
--- 6.1.1.2.3.
Von der Interaktion zwischen Zwischenwirt und Vektor bestimmte Faktoren
--- 6.1.1.2.4.
Von der Interaktion zwischen Vektor und Parasit bestimmte Faktoren
- 6.1.2. Zygote
-- 6.1.2.1. Das Genom von Plasmodien
--- 6.1.2.1.1. Genetische
Variationen
---
6.1.2.1.2. Genetische Struktur von Plasmodium falciparum-Populationen
---
6.1.2.1.3. Epidemiologische Folgen der Genomvielzahl
- 6.1.3. Ookinet
- 6.1.4. Oozyste
-- 6.1.4.1 Bildung der Sporoblasten
-- 6.1.4.2. Bildung der Sporozoiten
- 6.1.5. Sporozoiten
-- 6.1.5.1. Morphologie des Sporozoiten
-- 6.1.5.2. Fortbewegung des Sporozoiten
-- 6.1.5.3. Invasion der
Speicheldrüsen
-- 6.1.5.4.
Überlebensfähigkeit und Infektivität des Sporozoiten in
den Speicheldrüsen
-- 6.1.5.5. Übertragung
auf den Menschen
6.2. Ungeschlechtliche Schizogonie
im Menschen
- 6.2.1. Sporozoiten
-- 6.2.1.1. Transport zur Leber
-- 6.2.1.2. Rolle des CS-Proteins
--- 6.2.1.2.1.
Expression des CS-Proteins
-- 6.2.1.3. Anbindung an die
Hepatozyten
-- 6.2.1.4. Mögliche Rolle
der Kupferzellen
- 6.2.2. Leberschizont
- 6.2.3. Merozoiten
-- 6.2.3.1. Morphologie des Merozoiten
--- 6.2.3.1.1. Apikaler
Komplex
--- 6.2.3.1.2. "Dense bodies"
--- 6.2.3.1.3. Pellikula
--- 6.2.3.1.4. "surface coat"
-- 6.2.3.2. Invasion des Erythrozyten
--- 6.2.3.2.1. Bindung
an den Erythrozyten
--- 6.2.3.2.2. Eindringen
in den Erythrozyten
--- 6.2.3.2.3.
Entwicklung vom Merozoiten zum Trophozoiten
- 6.2.4. Trophozoiten
-- 6.2.4.1. Morphologie des Trophozoiten
-- 6.2.4.2. Entwicklung des Trophozoiten
-- 6.2.4.3. Ernährung des
Trophozoiten
-- 6.2.4.4. "Winterschlaf"-stadien
- 6.2.5. Blutschizont
-- 6.2.5.1.
Morphologische Veränderungen im Blutschizonten
-- 6.2.5.2. Durch den
Parasiten hervorgerufene Veränderungen des Erythrozyten
--- 6.2.5.2.1. Knobs
--- 6.2.5.2.2.
Caveolavesikuläre Komplexe
--- 6.2.5.2.3. Zytoplasmatische
Spalträume
--- 6.2.5.2.4. Tubovesikulärer
Komplex
-- 6.2.5.3. Kohlenhydratstoffwechsel
--- 6.2.5.3.1. Glukoseverbrauch
--- 6.2.5.3.2. Glukoseabbau
-- 6.2.5.4. Hämoglobinabbau und
Aminosäuremetabolismus
--- 6.2.5.4.1. Transport
des Hämoglobins
--- 6.2.5.4.2.
Bedeutung des Hämoglobins für den Parasiten
--- 6.2.5.4.3.
Weitere Aminosäurequellen
- 6.2.6. Weibliche
Makrogametozyten und männliche Mikrogametozyten
-- 6.2.6.1. Einflussfaktoren
auf die Gametozytogenesis
-- 6.2.6.2. Fünf
Stadien der Gametozytogenesis in Plasmodium falciparum
-- 6.2.6.3. Besonderheiten
in der Gametozytogenesis von Plasmodium falciparum
-- 6.2.6.3. Epidemiologische
Konsequenzen der Gametozytogenesis
6.3. Zusammenfassung des
Lebenszyklus
- 6.3.1. Die Entwicklung der Malariaparasiten
im Überblick
-- 6.3.1.1.
Entwicklung in der Stechmücke
-- 6.3.1.2. Entwicklung
im Menschen
- 6.3.2. Tabelle zur Entwicklung
der Malariaparasiten
- 6.3.3. Grössenvergleich: Mensch
- Stechmücke - Malariaerreger
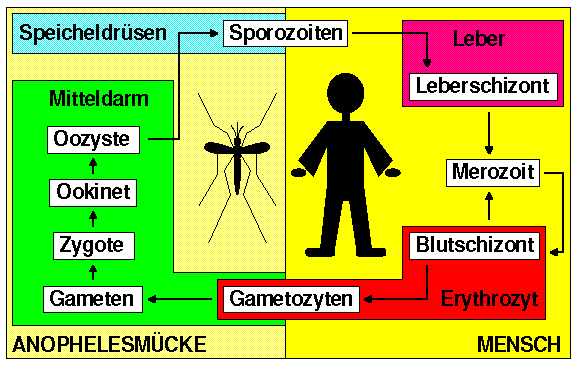
Der äusserst komplizierte Lebenszyklus der Malariaerreger lässt sich grob in zwei Abschnitte unterteilen: Die geschlechtliche Entwicklung in der Anophelesmücke (Endwirt) und die ungeschlechtliche Schizogonie im Menschen (Zwischenwirt).
Beide Abschnitte beinhalten zahlreiche Entwicklungsphasen, die im folgenden beschrieben werden. Auf Unterschiede zwischen den Erregern Plasmodium falciparum und Plasmodium vivax, sowie Plasmodium malariae und Plasmodium ovale, wird sofern bekannt jeweils in den einzelnen Textabschnitten hingewiesen.

Schematische Darstellung des Lebenszyklus von Plasmodium sp.
Für die Beschreibung der einzelnen Phasen wurde vor allem Shermans "Malaria: Parasite Biology, Pathogenesis, and Protection" zu Rate gezogen. Dabei wurde im Gegensatz zu den anderen Kapiteln weitgehend darauf verzichtet, die entsprechende Fachsprache zu vermeiden, da die "Alltagssprache" über keine hinreichend differenzierten Begriffe verfügt. Sofern die Fachbegriffe nicht im Text selbst erklärt werden, können sie im Glossar nachgeschlagen werden.
Kritisch anzumerken bleibt, dass trotz eines gewaltigen Wissenszuwachses in den letzten Jahren nur Plasmodium falciparum und einige als Modelle dienende Malariaerreger von Vögeln und verschiedenen Säugetieren genauer erforscht sind. Viele Fragen zum Lebenszyklus der Malariaparasiten bleiben ungeklärt. Auf biochemischer Ebene liegen zwar zahlreiche Einzelerkenntnisse vor, diese ergeben aber bisher noch kein kohärentes Gesamtbild, weshalb weitgehend darauf verzichtet wurde, diese Ebene in die Beschreibung einfliessen zu lassen.
Zur besseren Orientierung im Text werden die beiden grossen Entwicklungsabschnitte der Malariaparasiten im Menschen und der Anophelesmücke jeweils von einem kurzen Überblick über die wichtigsten Entwicklungsphasen eingeleitet. Den einzelnen Phasen wird in der Regel eine morphologische Beschreibung der entsprechenden Parasitenformen vorangestellt, gefolgt von Details der Entwicklung.
Am Schluss des Kapitels erfolgt eine Zusammenfassung des Lebenszyklus, welcher der Einordnung der Detailangaben in einen grösseren Zusammenhang dienen soll.
Zurück zur Orientierung "Lebenszyklus"
Die weibliche Anophelesmücke dient den vier Malariaerregern des Menschen als Endwirt, d.h. in ihr findet die geschlechtliche Entwicklung der Parasiten in mehreren Schritten statt, an deren Ende die Möglichkeit einer Neuinfektion des Zwischenwirtes Mensch steht.
Wenn eine Anophelesmücke beim Blutsaugen die Vorstufen der Geschlechtsformen (Gametozyten) eines Malariaparasiten aufnimmt, entwickeln sich diese rasch zu reifen Geschlechtsformen (Makrogamet und Mikrogamet), die ihre Wirtszellen verlassen und sich zu einer befruchteten Eizelle (Zygote) vereinigen. Die Zygote formt sich zum Ookineten um, und dringt in das Darmgewebe der Stechmücke ein, wo sie sich als Oozyste einnistet. Nach einer Weile entlässt die Oozyste zahlreiche ungeschlechtliche Erreger (Sporozoiten), welche in die Speicheldrüse der Stechmücke vordringen, wo sie bei der nächsten Blutmahlzeit einen Menschen infizieren können.
Zurück zur Orientierung "Lebenszyklus"
Stechmücken sind ein zentrales Element im Lebenszyklus der Malariaerreger. Ohne sie kann eine Übertragung der Krankheit auf natürlichem Weg kaum stattfinden. — In seltenen Fällen kommt es zu einer Ansteckung eines Neugeborenen durch infiziertes Blut der Mutter. — Trotzdem ist bei weitem nicht jede Stechmücke Überträgerin der Krankheit.
Nur Stechmücken der Gattung Anopheles — erkennbar an der charakteristischen Körperhaltung — unterstützen die sexuelle Entwicklung der menschlichen Malariaparasiten. Wobei von den weltweit rund 400 existierenden Anophelesarten nur etwa 60 als mögliche Malariavektoren gelten.
Einige Anophelesarten sind selten, andere saugen nicht beim Menschen, wieder andere leben nicht lang genug, um den Malariazyklus aufrechtzuerhalten, und einige sind nicht in der Lage, die sexuelle Entwicklung bis hin zum Sporozoitenstadium zu unterstützen. Viele der Überträgerarten sind polymorph. In einigen Fällen finden sich stark unterschiedliche Formen in verschiedenen geographischen Gebieten oder unter unterschiedlichen ökologischen Voraussetzungen. Einige dieser Populationen können im Bezug auf die Verbreitung der Malaria weit bedeutsamer sein, als eine ihrer nur wenig anderen Nachbarpopulationen. Und selbst innerhalb einer Population sind individuelle Unterschiede bezüglich der Übertragbarkeit von Malaria vorhanden.
Eine Anophelesmücke infiziert sich, nachdem sie menschliches Blut, welches reife Gametozyten enthält, gesaugt hat. Infizierte Menschen, welche Parasiten im Gametozytenstadium in ihrem Blut aufweisen, konstitutionieren also das natürliche "Infektionsreservoir". [Sherman, 1998, S. 57-58] Die Wahrscheinlichkeit, dass eine Stechmücke sich beim Blutsaugen infiziert hängt sowohl von der Anzahl als auch der Qualität der aufgenommenen Gametozyten, sowie einer Reihe von weiteren Faktoren ab.
Der erste Entwicklungsschritt des Malariaparasiten nach der Blutmahlzeit im Darm der Stechmücke wird als Gametogenesis bezeichnet.
Zurück zur Orientierung "Lebenszyklus"
Die Gametogenesis, d.h. die Ausdifferenzierung der sich noch in den Erythrozyten aufhaltenden männlichen und weiblichen Geschlechtszellen (Gametozyten) des Parasiten wird durch eine Kombination von äusseren Einflüssen ausgelöst, von denen der wichtigste ein Temperatursturz von 2 - 5° C ist. Der Temperatursturz wird durch den Übergang vom warmblütigen Menschen auf die wechselwarme Anophelesmücke verursacht. Zusätzlich spielen Blut-pH und die Bikarbonatkonzentration, resp. die HCO3-Konzentration, sowie die Konzentration von Xanthurenicsäure eine Rolle. [Sherman, 1998, S. 33]
Ist die Entwicklung erst einmal initiiert, zeigen sowohl die grössere weibliche (Makrogametozyt) als auch die kleinere männliche Geschlechtszelle (Mikrogametozyt) des Parasiten auffällige morphologische Veränderungen, die mit einer überraschenden Geschwindigkeit ablaufen.
Zurück zur Orientierung "Lebenszyklus"
Für die Makrogametogenesis ist nur eine minimale äussere Veränderung nötig. Die länglichen Gametozyten nehmen innerhalb von zwei bis drei Minuten eine rundliche Form an und ihr Volumen kann bis auf das dreifache Ausgangsvolumen ansteigen. Im Zellplasma fusionieren die osmiophilen Körperchen mit dem Plasmalemma und entleeren ihren Inhalt in die parasitophore Vakuole. Danach werden in rascher Folge die parasitophore Vakuole und die erythrozytäre Plasmalemma abgebaut, und die expandierte unbefruchtete weibliche Eizelle durch die Zerstörung des Erythrozyten, welche mechanisch durch die Darmbewegungen der Anophelesmücke, chemisch durch Verdauungsenzyme oder durch den Gametozyten selbst erfolgen kann, in die Blutmahlzeit entlassen. [Sherman, 1998, S. 33, 35]
Zurück zur Orientierung "Lebenszyklus"
Die Mikrogametogenesis schliesst sowohl die gleichen Änderungen in der Zellform als auch den Ausbruch aus dem Erythrozyten ein, aber die kleinere Anzahl der osmiophilen Körperchen im männlichen Gametozyten korreliert mit einem vorerst weniger erfolgreichen Ausbruch aus dem Erythrozyten, welcher teilweise erst nach der Exflagellation durch die zuckenden Bewegungen des Gameten zerstört wird. [Sherman, 1998, S.35-36]
Im Zellplasma formt sich das die Mikrotubuli organisierende Zentrum innerhalb von 15 Sekunden in acht in zwei orthogonalen Tetraden gestapelte Kinetosome um. Unmittelbar danach formt sich die erste Mitosespindel aus einer einzigen Spindelplaque, teilt sich und die Spindelpole rotieren in der Kernhülle und wandern auseinander. Nach zwei Minuten stehen sich die Pole auf unterschiedlichen Seiten des Zellkernes gegenüber. Nach fünf bis sechs Minuten teilt sich jeder der separierten Spindeln innerhalb des Zellkerns noch einmal und nach acht Minuten teilen sich die vier resultierenden Spindelpole durch eine Mitose. In jeder der dazwischenliegenden Perioden repliziert sich das gesamte Genom ohne dabei je zu sichtbaren Chromosomen zu kondensieren.
Die acht Kinetosomen des Zellplasmas agieren als Zentrum für den Aufbau der 22 µm langen Axonem: Die Kinetosomen bleiben durch die Kernporen eng mit der mitotischen Spindelplaque verbunden und werden während der zweiten und dritten Kernteilung von einem vesikulo-tubulären Netzwerk eingeschlossen, das mit der Plasmamembran verbunden ist.
Im Moment der Exflagellation wird das Flagellum aktiviert und in 15 Sekunden aus dem Zellplasma gedrängt. Die noch immer existierende Verbindung der Kinetosomen zur Spindel zieht das haploide Genom in das Flagellum. Erst in diesem Stadium kondensiert das Genom. Folge diesen raschen Ablaufs sind bis zu 60% von der Norm abweichende oder kernlose Mikrogameten.
Der männliche Mikrogamet weist im Gegensatz zum weiblichen keine Mitochondrien oder andere Plastidenstrukturen auf. Er bewegt sich mit alternierenden schnellen und langsamen Wellenbewegungen vorwärts. [Sherman, 1998, S. 36-37]
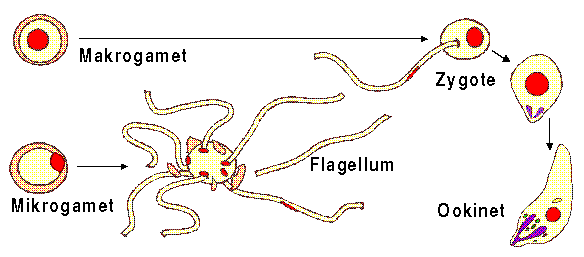
Entwicklung von den Gameten zum Ookinet [nach Brown]
Zurück zur Orientierung "Lebenszyklus"
Ob sich eine Anophelesmücke (Vektor) während einer Blutmahlzeit an einem von Malariaparasiten befallenen Zwischenwirten, z. B. einem Menschen, infiziert, hängt nur sehr bedingt von der Zahl der im Blut des Opfers befindlichen Gametozyten ab. Verschiedene weitere Faktoren beeinflussen die Infektionsrate in hohem Masse. [Sherman, 1998, S. 31] Dazu gehören: Faktoren, die nur durch den Zwischenwirt bestimmt werden; Faktoren, welche auf Interaktionen zwischen Parasit und Zwischenwirt zurückzuführen sind; Faktoren, die aus Interaktionen von Zwischenwirt und Vektor resultieren. und von der Interaktion zwischen Parasit und Vektor bestimmte Faktoren.
Zurück zur Orientierung "Lebenszyklus"
Neben der Beschaffenheit der Blutbestandteile Plasma, Serum und Hämoglobin, die notwendige Bestandteile für die weitere Entwicklung des Malariaparasiten in der Anophelesmücke sind, bestimmen genetische Abweichungen die Wahrscheinlichkeit einer Infektion des Vektors durch eine Blutmahlzeit. So weisen etwa heterozygote Träger der Sichelzellenanämie mit A/S-Merkmal gegenüber A/A-Individuen, die nicht Träger des Sichelzellenanämiegenes sind, eine erhöhte Infektionsrate von 35% gegenüber 17% auf. [Sherman, 1998, S. 31]
Zurück zur Orientierung "Lebenszyklus"
Der Hämatokritlevel im Blut des Zwischenwirtes beeinflusst die Infektionsrate der Malariaerreger für Anophelesmücke in konträrer Weise: Während eine Herabsetzung der Hämoglobinkonzentration eine reduzierte Infektionsrate zur Folge zu haben scheint, führt eine geringe Reduktion des Hämatokrit — eine Folge der asexuellen Vermehrung des Parasiten — dazu, dass die blutsaugende Anophelesmücke ein grösseres Blutvolumen zu sich nimmt, was eine mögliche Infektion begünstigt. [Sherman, 1998, S. 31-32]
Eine hohe asexuelle Parasitämie beeinflusst durch zunehmende Laktatazidose den Bikarbonatlevel und damit auch den Blut-pH. Sinkt der Blut-pH unter einen Wert von 7.2 oder der Bikarbonatlevel unter 20 mM ist eine Infektion der Anophelesmücke nicht mehr möglich. [Sherman, 1998, S. 32] Steigt die Zahl der ungeschlechtlichen Plasmodium falciparum-Parasiten auf mehr als 1'000 pro µl, verlieren die Gametozyten einen Teil ihrer Infektivität. [WHO, 1987, S. 34]
Auch die während der Schizogonie von asexuellen Parasiten in den Blutstrom entlassene Toxine scheinen über dadurch verursachte Schwankungen des gamma-Interferonlevels und des Tumor-Nekrose-Faktors (TNF) einen Einfluss auf die Gametozyten zu haben: Bei Plasmodium vivax, mit einer ausgesprochen synchronen Schizogonie, wurde während des Ausbruchs der Merozoiten aus den Erythrozyten eine reduzierte Infektionsfähigkeit festgestellt. [Sherman, 1998, S. 32]
Zurück zur Orientierung "Lebenszyklus"
Grössere Anophelesmücke saugen in der Regel mehr Blut, was zumindest theoretisch zu einer höheren Infektionsrate führt. Auch das Alter einer Anophelesmücke hat einen Einfluss auf die aufgenommene Blutmenge: Die erste oder zweite Blutmahlzeit, je nach Art, ist gewöhnlich die grösste und birgt damit ein erhöhtes Infektionsrisiko. Zusätzlich weisen jüngere Anophelesmücke eine grössere Überlebenswahrscheinlichkeit bis zum Zeitpunkt der Sporozoitenreifung auf, was einen Einfluss auf die Vollendung des Infektionszyklus hat.
Für Plasmodium falciparum werden die grössten Gametozytendichten in kleinen Kindern beobachtet, von denen die weniger als ein Jahr alten eine sehr hohe Gametozytämie aufweisen. Der Grund dafür ist unbekannt.
Auch der Zeitraum zwischen zwei Blutmahlzeiten einer Gametozytämie scheint einen Einfluss auf den Infektionszyklus zu haben: Die zum Abbau einer 24 Stunden alten Blutmahlzeit benötigten Enzyme im Darm der Anophelesmücke verhindern eine Weiterentwicklung des Ookineten. Hinzu kommt die selbst im Darm der Stechmücke noch anhaltende phagozytische Tätigkeit der Leukozyten, welche einen Teil der extrazellulären geschlechtlichen Formen des Parasiten trotz zunehmender Einschränkung durch die Verdauungstätigkeit der Stechmücke abtöten können.
Nicht zuletzt erleichtert die durch einen Parasitenbefall hervorgerufene Schwächung eines Patienten es der Stechmücke, leichter an eine Blutmahlzeit zu kommen, da entsprechende Abwehrreaktionen ausbleiben oder nur in abgeschwächter Form auftreten. Dadurch wird die Wahrscheinlichkeit einer Infektion erhöht. [Sherman, 1998, S. 33]
Zurück zur Orientierung "Lebenszyklus"
Stechmücken der Gattung Anopheles und Culex weisen signifikante Unterschiede im Wasser-/Ionenhaushalt der Blutmahlzeit auf: Anopheline Stechmücken konzentrieren den Inhalt der Blutmahlzeit rasch auf bis die Hälfte des Volumens. Stechmücken der Gattung Culex hingegen formen in den ersten 24 Stunden nach der Blutmahlzeit ein Gel. Der Einfluss dieser Konzentrationsunterschiede auf die Entwicklung des Malariaparasiten sind nicht erforscht, sicher ist aber, dass nur Anophelesmücke Überträger der Malaria sind. [Sherman, 1998, S. 34]
Zurück zur Orientierung "Lebenszyklus"
Bei der Befruchtung des weiblichen Makrogameten durch den männlichen Mikrogameten, die normalerweise eine Stunde nach der Gametogenesis stattfindet, verschmelzen die Plasmamembranen der beiden Gameten zu einer mosaikförmigen Struktur. Axomen und Kern des Mikrogameten dringen in das Zellplasma des Makrogameten ein, wobei das Axomen noch bis zu 20 Minuten nach dem Eindringen schlagende Bewegungen ausführt. [Sherman, 1998, S. 37]
In den nächsten 12 bis 24 Stunden formt sich die Zygote zum Ookineten um: Nach der Verschmelzung der beiden Zellkerne entwickelt sich ein aus Mikrotubuli bestehendes Netzwerk aus dem Zentriol des die Mikrotubuli steuernden Zentrums um den Zellkern der Zygote. Aus diesem Zentrum entstehen auch die subpellikulären Mikrotubuli der Ookinetenpellikula. Unter der Pellikula formen sich sich zwischen den Mikrotubuli und der Plasmamembran abgeflachte Membranvesikel. Während der Polymerisation der Mikrotubuli drückt die pellikuläre Expansion die apikale Erhebung aus der Oberfläche der Zygote und verleiht ihr damit die typische Ookinetenform. Der apikale Komplex erscheint im Ookineten ausgeprägter als im Sporozoiten oder Merozoiten. [Sherman, 1998, S. 37-38]
Das die Mikrotubuli organisierende Zentrum formt sich zu einem klar abgegrenzten Ring, vor dem sich kleine Polringe entwickeln. Zwischen diesen beiden Strukturen und der Pellikula endet die innere Membranvakuole in einer auffallenden apikalen Verdickung. Die Steifigkeit dieser Struktur könnte einen Einfluss auf die Fähigkeit des reifen Ookineten haben, sich durch die Blutmahlzeit, das peritrophische Grundgewebe und das Deckgewebe des Mitteldarmes zu graben. [Sherman, 1998, S. 38]
Im Zellplasma findet eine einzigartige Auswechslung der Ribosomenpopulation statt. Die vom Makrogametozyten übernommenen A-Stadien rRNAs (A = asexuelle Stadien) werden durch S-Stadien (S = sexuelle Stadien) Ribosomen ersetzt. Der reife Ookinet enthält deshalb eine gemischte Population von A/A-, S/S- und wahrscheinlich auch A/S-Ribosomen.
Die unterschiedlichen Ribosomen dienen dem Parasiten möglicherweise als Anpassung an die Temperaturdifferenzen zwischen Mensch (37 ± 4° C) und Stechmücke (20 ± 20°C). [Sherman, 1998, S. 38]
In der überdauernden Kernhülle, vollzieht die diploide Zygote eine meiotische Teilungen, welche die Neukombination des weiblichen und männlichen Genoms erlaubt und in vier separaten haploiden Genomkopien in jedem der Zellkerne resultiert. [Sherman, 1998, S. 39]
Die 14 Chromosomen der menschlichen Malariaerreger sind zu klein, um im Lichtmikroskop gesehen zu werden, deshalb konnte ihre genaue Anzahl erst in den 80er Jahren mit Hilfe der Gel-Elektropheresis festgestellt werden. Das gesamte Genom von Plasmodium falciparum umfasst rund 25 - 30 Millionen Basenpaare, beträgt also etwa ein Prozent des menschlichen Genoms. Die Grösse der Chromosomen von Plasmodium falciparum reicht von 650 kb (Kilobasen) bis zu 3400 kb. Die Grösse von homologen Chromosomen in Plasmodium falciparum-Parasiten unterschiedlicher Herkunft unterliegt zudem grossen Schwankungen, eine Tatsache welche die grossen Unterschiede zwischen verschiedenen Individuen einer Parasitenpopulation spiegelt. Neben den Chromosomen besitzen Malariaparasiten zwei DNA-Elemente ausserhalb des Zellkerns: eine 6 kb Sequenz in den Mitochondrien und ein ringförmiges 35 kb DNA-Molekül mit plastid-ähnlichen Genen, das wahrscheinlich in den mit dem Golgiapparat assoziierten "doppelwandigen Vesikel" zu finden ist.
Das Genom der Malariaparasiten ist während des grössten Teils eines Zyklus haploid. Die einzige diploide Phase entsteht, wenn ein Mikrogamet einen Makrogameten befruchtet und sich dadurch eine Zygote bildet. Bereits wenige Stunden nach diesem Ereignis setzt aber die Meiose ein, die wiederum ein haploides Genom erzeugt. [Sherman, 1998, S. 235-238, 254]
Zurück zur Orientierung "Lebenszyklus"
Genetische Variationen haben ihren Ursprung in der Mutation einzelner Gene. Ist eine Mutation aber erst einmal eingetreten, bildet die Neukombination von Genen die Hauptursache für das Entstehen neuer Genotypen. In Eukaryoten findet diese Neukombination hauptsächlich während der Meiose statt, seltener während der Mitose.
Findet die Befruchtung zwischen zwei Gameten eines einzigen Klones statt, ist eine in allen Genen homozygote Zygote das Resultat. Wenn es zur Befruchtung von Gameten verschiedener Klone kommt, können heterozygote Zygoten entstehen, welche durch Crossing-over während der Meiose neue Rekombinationsmöglichkeiten schaffen. Untersuchungen an Plasmodium falciparum haben gezeigt, dass solche Neukombinationen häufig vorkommen. [Sherman, 1998, S. 239]
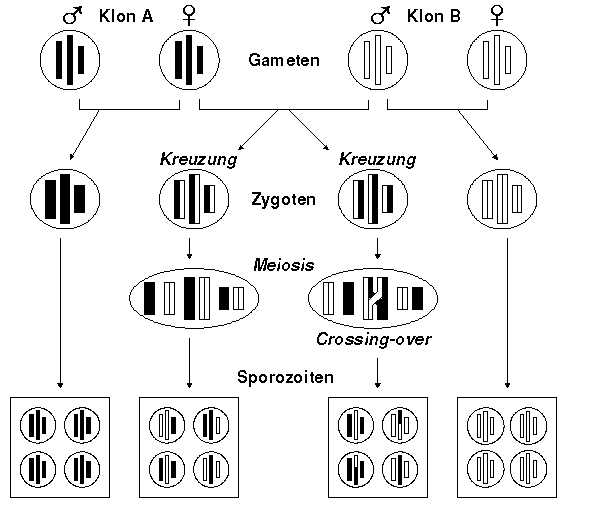
Entstehung neuer Genotypen bei Plasmodien [nach Sherman,
1998, S. 237]
Zurück zur Orientierung "Lebenszyklus"
In den meisten in Asien und Afrika durchgeführten Studien wurden drei Eigenschaften von Plasmodium falciparum-Populationen festgestellt. 1. Die meisten Populationen weisen eine beträchtliche Variation der Allele in vielen Genen auf. 2. Die Häufigkeit eines Allels in einer Population unterliegt einer geographischen Variation. 3. Die Mehrheit der Menschen weisen eine Infektion mit mehreren Klonen eines Parasiten auf. All diese Befunde belegen nicht nur ein grosses Potential für Neukombinationen, sie sind auch im Hinblick auf die zunehmende Resistenzbildung gegenüber Medikamenten und im Hinblick auf eine zukünftige Impfung von Bedeutung, da jederzeit neue Parasitenklone mit neuen Eigenschaften entstehen können.
Auch das Zahlenverhältnis der Parasitenklone in einem Patienten verändert sich im Laufe der Zeit und kann täglichen Schwankungen unterworfen sein. Eine Untersuchung an Kindern in einem hochendemischen Gebiet Tansanias zeigte, dass die Genotypenmehrheit der untersuchten Parasiten in einem 24 Stundenzyklus schwankte. So trat beispielsweise ein erster Genotyp an den Tagen 1 und 3 zum Vorschein, während ein anderer an den Tagen 2 und 4 nachgewiesen werden konnte. Zusätzlich ergaben sich in einem Zeitraum von weniger als zwei Wochen Hinweise auf Neuinfektion mit Klonen eines dritten Genotyps. [Sherman, 1998, S. 239]
Die gleichzeitige Infektion mit verschiedenen Klonen in einzelnen Menschen deutet darauf hin, dass die Gesamtzahl der existierenden Genotypen zu einer bestimmten Zeit in einer Gemeinschaft äussert hoch ist. Eine Studie im Westsudan hat dann auch gezeigt, dass von 800 Personen alle Infektionen durch Parasiten unterschiedlicher Genotypen aufwiesen [Sherman, 1998, S. 241]
Zurück zur Orientierung "Lebenszyklus"
Die Vielzahl unterschiedlicher Genome in einer Parasitenpopulation eines endemischen Malariagebietes führt dazu, dass die Wahrscheinlichkeit der Bildung einer Resistenz gegenüber einem Medikament steigt. Ist eine Resistenz erst einmal entstanden sorgt der Selektionsdruck durch die Verwendung des Medikamentes dazu, dass sich die resistente Parasitenvariation gegenüber anderen Varianten durchsetzt, da eine rasche Verbreitung der neuen Parasitenvariante möglich ist. Eine Resistenz gegen ein Medikament kann in hochendemischen Gebieten also nicht nur leichter entstehen, sie findet auch schneller Verbreitung, mit dem Resultat, dass ein Medikament innert weniger Jahre wirkungslos werden kann. [Sherman, 1998, S. 247] (Siehe dazu "Folgen von Resistenz gegenüber Malariamedikamenten".)
Zurück zur Orientierung "Lebenszyklus"
Der ausgereifte Ookinet hat eine charakteristische handförmige Gestalt, die von einem die ganze vordere Hälfte der Zelle umfassenden Zellskelett gestützt wird. Der Ookinet bewegt sich, gesteuert von der Verteilung der Mikrotubuli in der Pellikula langsam gleitend vorwärts Richtung Hämozöl. Wenn der apikale Komplex mit einem Erythrozyten in der Blutmahlzeit in Berührung kommt, wird das Blutkörperchen zerstört. [Sherman, 1998, S. 40]
Nach der Durchquerung des peritrophischen Grundgewebes ist der Ookinet zwar nahe am Deckgewebe des Mitteldarmes, aber auch in einem an Verdauungsenzymen überschwemmten Bereich. Da der Ookinet von diesen Enzymen angegriffen werden kann, muss er in das Deckgewebe entfliehen. [Sherman, 1998, S. 41]
Sobald der apikale Komplex des Ookineten die Plasmamembran einer Epithelzelle im Darmgewebe der Mücke berührt, kommt es zu einer engen Verbindung des Glykocalix der beiden Zellen und einer lokalen Ausschüttung der in den Rhoptrien und Mikronemen enthaltenen Sekrete in die vom Parasiten induzierte Erhebungen der Plasmamembran der Wirtszelle. Der Ookinet bewegt sich in die dadurch geformte Vakuole in der Wirtszelle. Häufig kommt es dabei zu keiner vollständigen Ausformung der Vakuole oder diese zerfällt rasch und der Ookinet findet sich im Zellplasma der Wirtszelle wieder. Während seiner Wanderung kann der Ookinet mehrere Epithelzellen durchdringen oder aber direkt zur Lamina basalis vorstossen. Die vom Parasiten befallenen Epithelzellen zeigen häufig eine weniger grosse Dichte als parasitenfreie Zellen, ob aber der Parasit weniger dichte Zellen bevorzugt oder der beobachtete Unterschied eine Folge der Invasion ist, bleibt ungeklärt. Die Mitochondrien und der Kern befallener Zellen zeigen Symptome einer osmotischen Unausgeglichenheit und eine Verdichtung des Chromatins (Apoptosis). Während seiner Wanderung durch die Mitteldarmwand hinterlässt der Ookinet eine Spur von Oberflächenantigenen. Obwohl diese Spur über weite Distanzen innerhalb des Gewebes verfolgt werden können, ist nicht klar, ob sie im Epithelium oder zwischen Epithel und Lamina basalis liegt. Hat der Ookinet die Lamina basalis erreicht, formt er sich zur Oozyste ohne zum Hämozöl vorzudringen [Sherman, 1998, S. 43, 49]
Diese Position zwischen der Grundmembran und der Lamina basalis des Mitteldarmes erlaubt der Oozyste eine Einwicklung in einer immunologisch privilegierten Umgebung, da sie nicht direkt den Angriffen der an die Blutzellen gebundene Verteidigung der Stechmücke ausgesetzt ist. [Sherman, 1998, S. 49]
Während der Transformation zur Oozyste verschwinden eine Reihe von für den Ookineten typischen Strukturen, inklusive der unter der Pellikula liegenden Mikrotubuli und des apikalen Komplexes. Nicht alle Ookineten nisten sich erfolgreich als Oozysten ein. Schon RONALD ROSS hatte in seinen Studien zur Übertragung der Malaria erkannt, dass in einigen Stechmücken, die als Vektoren, gelten, die Parasiten in braunen Kapseln am Darmgewebe degenerieren. Nach der Einkapselung, die beispielsweise in Anopheles gambiae R Stechmücken beobachtet werden kann, wird der Parasit durch Melanisation, einer Standardverteidigung von Insekten gegenüber eindringenden Mikroorganismen, abgetötet. — Interessanterweise kann Anopheles gambiae R (R für refraction = Abstossung) eine Vielzahl von Plasmodienarten, inklusiv vieler Plasmodium falciparum-Varianten aus den meisten Erdteilen erfolgreich melanisieren. Bei den aus medizinischer Sicht interessierenden, in den gleichen Gebieten Afrikas heimischen Plasmodium falciparum-Varianten bleibt dieser Verteidigungsmechanismus aus unbekannter Gründen erfolglos. [Sherman, 1998, S. 49-50] Nach Untersuchungen des European Molecular Biology Laboratory in Heidelberg und des Center for Disease Control and Prevention in Chamblee (USA) führt das komplexe Zusammenspiel von drei unterschiedlichen Genen zu einer Erkennung des eindringenden Parasiten und dessen Einkapselung in Anopheles gambiae R. [Die Welt, 13.05.1999]
Auch wenn die Ookineten ihre Entwicklung normalerweise physisch von der Hämolymphe durch die Barriere der Lamina basalis des Mitteldarmes getrennt durchlaufen, so ist ein Zugang zu dieser doch möglich: Die sich entwickelnde Oozyste streckt die Lamina basalis, und in sieben bis acht Tagen, im Fall von Plasmodium falciparum, ist sie nur noch 0.2 um dick und als feine Schicht über dem Parasiten kaum mehr erkennbar. Ausserdem scheint ein direkter Zugang zur Hämolymphe für die Entwicklung nicht zwingend zu sein. Während ihrer Wanderung im Deckgewebe des Mitteldarmes steckengebliebene Ookineten können sich, wenn auch langsamer, doch zu Oozysten weiterentwickeln. [Sherman, 1998, S. 50]
Vom Eindringen des Malariaparasiten in die Stechmücke bei der Aufnahme von infiziertem Blut bis zur Einnistung als Oozyste, muss der Parasit in einer schwierigen Umgebung eine ganze Reihe von Hindernissen überwinden. Entsprechend hoch sind die Verluste: Von geschätzten rund 15'000 in einer Blutmahlzeit aufgenommenen Gametozyten überleben ca. 2500 Makrogameten, aus denen ca. 70 befruchtete Ookineten hervorgehen, von denen wiederum durchschnittlich einer Oozyste die Einnistung in das Mitteldarmgewebe der Stechmücke gelingt. [Sherman, 1998, S. 41]
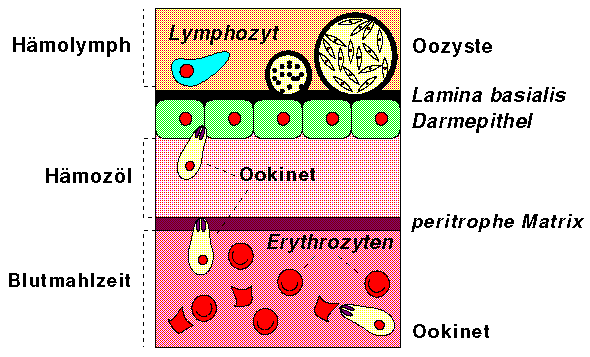
Entwicklung vom Ookineten zur Oozyste [nach Mehlhorn,
1998, S. 407; Sherman, 1998, S.
32, 42]
Zurück zur Orientierung "Lebenszyklus"
Während die Oozyste sich ausdifferenziert, nimmt sie eine rundliche Form an und in ihrem Innern entstehen eine oder mehrere zytoplasmatische Inseln, die als Sporoblasten bezeichnet werden. Aus der membrangebundenen Oberfläche des Sporoblasten keimen die sogenannten Sporozoiten. Je ein Zellkern und zytoplasmatische Organellen werden vom Sporoblasten in die sich entwickelnden, dabei zunehmend an Länge gewinnenden Sporozoiten transferiert. Sind die Sporozoiten voll entwickelt, zerreisst die Membran der nun einen Durchmesser von bis zu 500 µm erreichende Oozyste, und die Sporozoiten werden in die Hämolymphe der Stechmücke entlassen. [Kayser, 1998, S. 534; Sherman, 1998, S. 50]
Zurück zur Orientierung "Lebenszyklus"
Die Transformation des wurmförmigen Ookineten in die runde Oozyste setzt etwa 18 bis 24 Stunden nach der Blutmahlzeit ein. Während dieses Prozesses wird die apikale Verdickung und das aus Mikrotubuli aufgebaute Zellskelett des Ookineten in das Zellplasma zurückgezogen. Die Oozyste wird von einer dichten fasrigen Kapsel eingehüllt, welche bei Plasmodium falciparum nach sechs bis neun Tagen eine maximale Dichte von 0.2 µm erreicht. Direkt unter dieser Kapsel liegt das Plasmalemma des Parasiten, welches das Zellplasma, den Zellkern und die sich formenden Sporoblasten umhüllt. Verteilt im Zellplasma des Sporoblasten finden sich verschiedene Organellen, inklusive eines endoplasmatischen Retikulums, freien Ribosomen, membrangebundenen Vesikeln und Mitochondrien. Der stark eingebuchtete Zellkern kann bis zu 30% des Oozystenvolumens ausfüllen. Die Oozyste durchläuft mehrfache synchron ablaufende Mitosen, die durch das Erscheinen von Spindelstrukturen ausgehend von der zentriolaren Plaque nahe der Kernhülle ausgehen. Diese Mitosen resultieren in einer schrittweisen Teilung des ursprünglich grossen Zellkernes in viele kleine Zellkerne, von denen jeder etwa einen Durchmesser von 1 µm aufweist. Die Anzahl und Bildung der in der Oozyste geformten Sporoblasten ist artabhängig. [Sherman, 1998, S. 51]
Zurück zur Orientierung "Lebenszyklus"
Die Entwicklung der Sporozoiten setzt, abhängig von der Art des Erregers und der herrschenden Temperatur, ungefähr sechs bis neun Tage nach der infektiösen Blutmahlzeit ein. Beim gut erforschten Plasmodium berghei, einem Malariaerreger in Ratten, werden Zellkerne von rund 7 µm Durchmesser beobachtet, die sich an den Rand des Sporoblasten bewegen und an der Seite zum Plasmalemma des Sporoblasten eine Abflachung erfahren. Das Einsetzen der Sporozoitenentwicklung wird von gleichzeitig auftretenden Vorgängen im Kern und im Zellplasma eingeleitet:
Spindelfasern mit charakteristischen Überkreuzungen formen sich an verschiedenen Punkten entlang der Innenseite der Kernhülle. Die Ausprägung dieser Spindeln wird von einer Neubildung von Membranplaque nahe der einzelnen Kernspindeln, direkt unter der Sporoblastenmembran begleitet. Nahe der Membranplaque zeigen sich Mikrotubuli, apikale Ringe und Rhoptrien, welche Teile der Morphologie des sich formenden Sporozoiten bilden. Schliesslich knospt ein Sporozoit an jedem dieser Punkte und verschiedene zytoplasmatische Komponenten fliessen aus dem Sporoblasten in den Sporozoiten.
Die den ursprünglichen Sporoblasten eingrenzende Plasmalemma formt die äussere Membran der Sporozoitenpellikula, während die neue darunterliegende Membranplaque sich weiter ausdehnt und die innere Komponente der Sporozoitenpellikula bildet. Dieser Prozess findet je nach Art entweder entlang der äusseren Seite der Sporoblastenplasmalemma oder entlang der inneren Membran des Sporoblasten, z. B. bei Plasmodium falciparum, statt.
Schlussendlich ist die Oozyste vollgepackt mit schätzungsweise 1'000 bis 10'000 fertig ausgeformten Sporozoiten, während die Sporoblasten zunehmend schrumpfen und zu einem oder mehreren Restkörperchen verkümmern. [Sherman, 1998, S. 51]
Zurück zur Orientierung "Lebenszyklus"
Die aus der Oozyste freigesetzten Sporozoiten nisten sich nach ihrer vollendeten Reifung in der Speicheldrüse der Anophelesmücke ein, wo sie über einen Zeitraum von bis zu einem Monat überleben können und von wo aus die Möglichkeit einer weiteren Malariainfektion eines Menschen besteht.
Der fertig ausgeformte Sporozoit ist eine bananenförmige, je nach Spezies zwischen 9 bis 16.5 µm lange und 0.4 bis 2.7 µm breite Zelle, die von einer Pellikula, bestehend aus einer äusseren Membrane — aus der Ausstülpung der begrenzenden Plasmamembran des Sporoblasten gebildet — und zwei inneren Membranen — während der Sporozoitenknospung neu gebildet —, umgeben ist. [Sherman, 1998, S. 52]
Direkt unter der Pellikula entlang der Längsachse des Sporozoiten liegt eine Reihe von Mikrotubuli. Am vorderen Ende des Sporozoiten sind diese unter der Pellikula liegenden Mikrotubuli mit zwei apikalen Ringen verbunden, welche den gesamten vorderen Teil umfangen. Die Mikrotubuli reichen etwa über die halbe Länge des Sporozoiten. Ein Querschnitt durch den Sporozoiten zeigt, dass die meisten der rund 15 Mikrotubuli etwa zwei Drittel des Umfanges des Sporozoiten umrunden, während das letzte Drittel nur von einem Mikrotubulus eingefasst wird. Diese asymmetrische Verteilung der Mikrotubuli ist möglicherweise die Ursache für die gekrümmte Form des Sporozoiten.
Die vordere Hälfte des Sporozoiten enthält zwei verschiedene Arten von Strukturen: die sogenannten Rhoptrien — dicke, normalerweise paarweise auftretende, längliche Strukturen, die aus dem apikalen Ende des Sporozoiten herauszuwachsen scheinen; und Mikronemen, die einen schmäleren Durchmesser haben und gewundener erscheinen als die Rhoptrien. Die Rhoptrien sind mit Phospholipiden gefüllt, die in multilaminaren Wirbeln hin zur äusseren Pellikula des Sporozoiten ausgesondert werden. Ähnliche Sekretwirbel wurden auch in Merozoiten beobachtet, und es wird vermutet, dass dieses Membranmaterial eine Bedeutung bei der Invasion einer Wirtszelle durch den Parasiten innehat.
Ein weiteres auffallendes Organ des Sporozoiten ist der zentral gelegene längliche Zellkern, dessen Kernhülle weit über das Kernplasma hinausreicht. Eng verbunden mit dem Zellkern sind ein oder zwei Mitochondrien. Ausserdem verfügt der Sporozoit über weitere Zellbestandteile wie Golgiapparat, endoplasmatisches Retikulum und freie Ribosomen. [Sherman, 1998, S. 53]
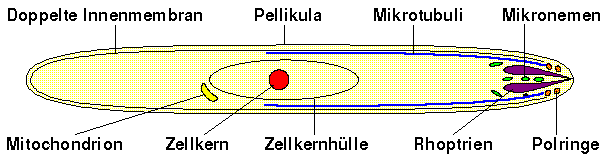
Schematische Zeichnung eines Sporozoiten [nach Beschreibung
Sherman, 1998, S. 52-53]
Zurück zur Orientierung "Lebenszyklus"
Die aus der Oozyste austretenden Sporozoiten zeigen eine charakteristische Fortbewegungsweise: Das apikale Ende knüpft am Substrat an und das freie Ende zeigt wellenförmige durch Krümmung hervorgerufene Bewegungen. Mit zunehmender Reifung des Sporozoiten in der Hämolymphe und den Speicheldrüsen wechselt der Parasit zu einer gleitenden Fortbewegung, die dem Sporozoiten ein Vorankommen ohne sichtbare Formveränderung ermöglicht.
Diese gleitende Fortbewegung ("gliding motility") wird durch Albumin ausgelöst und im reifen Sporozoiten von der Abgabe von circumsporozoite- (CS) Protein aus dem führenden apikale Ende begleitet. Das CS-Protein, welches erstmals fünf bis sechs Tage nach der Blutmahlzeit an der inneren Membran der Sporoblasten in Erscheinung tritt und eine wichtige Rolle bei der Invasion der Leberzellen (Hepatozyten) spielt, wird aussen an der Pellikula des Sporozoiten zu dem, dem apikalen Ende entgegengesetzten Pol geführt und ermöglicht dem Parasiten durch die Haftung am Substrat die Fortbewegung. Ähnlich der Schleimspur einer Schnecke lässt der Sporozoit eine Spur von CS-Protein hinter sich. Offensichtlich steht diese Art der Fortbewegung in einem engen Zusammenhang mit der Invasion von Wirtszellen durch den Sporozoiten. Ein zweites Oberflächenprotein des Sporozoiten, das thrombospondin related adhesiv protein (TRAP), scheint ebenfalls eine Rolle in der Fortbewegung und bei der Invasion der Hepatozyten zu spielen. [Sherman, 1998, S. 52-54]
Zurück zur Orientierung "Lebenszyklus"
Nachdem die Sporozoiten aus der Oozyste entlassen wurden, wandern sie in die Speicheldrüsen der infizierten Anophelesmücke ein. Ob die Sporozoiten in der Lage sind, die Speicheldrüsen aktiv zu orten oder per Zufall durch die schwache Strömung der Hämolymphe an ihren Zielort gelangen, um dort an die Zellen der Speicheldrüsen anzubinden, ist nicht bekannt. Interessanterweise scheint aber das schon erwähnte CS-Protein eine Rolle bei der Erkennung des Speicheldrüsengewebes der Stechmücke zu spielen. Weniger als ein Viertel aller von einer Oozyste produzierten Sporozoiten gelingt die Invasion der Speicheldrüsen, die anderen werden von der Anophelesmücke auf noch unbekannte Weise eliminiert. [Sherman, 1998, S. 54-55]
Basierend auf der Beobachtung von Plasmodium galluinaceum Sporozoiten in Aedes aegypti sind acht klar abgegrenzte Phasen der Invasion der Speicheldrüsen bekannt.
Der Sporozoit hängt sich an die Lamina basalis (1) und dringt dann in den Raum zwischen der Lamina basalis und der basalen Plasmamembran der Speicheldrüsenzellen vor. Während dieses Vorgangs verliert der Sporozoit seinen dicken Zellmantel (2). Danach durchdringt der Sporozoit die basale Plasmamembran (3) und dringt in die Zelle ein, wobei sowohl die innere als auch die äussere Vakuole von Mitochondrien umgeben ist (4). Durch das Durchdringen der apikalen Plasmamembran gelangt der Sporozoit in die Speicheldrüsenhöhle (5) worauf er sich in eine Vakuole einhüllt (6) und mit anderen Sporozoiten zu Parasitenbündeln zusammenschliesst (7). Schliesslich gelangen einzelne Sporozoiten aus diesen Bündeln in den Speicheldrüsengang der Anophelesmücke (8).
Bei der Invasion scheinen die Sporozoiten die mittleren und seitlichen Lappen der Speicheldrüsen zu bevorzugen. Eine Beobachtung die wahrscheinlich damit zusammenhängt, dass diese Regionen keine sklerotisierten Hindernisse zwischen den Speichelzellen und dem zentralen Speicheldrüsengang aufweisen. Sporozoiten, welche in den vorderen Teil der Speicheldrüsen eindringen wollten, hätten die sich dort befindende dicke Chitinbarriere zu überwinden. [Sherman, 1998, S. 55]
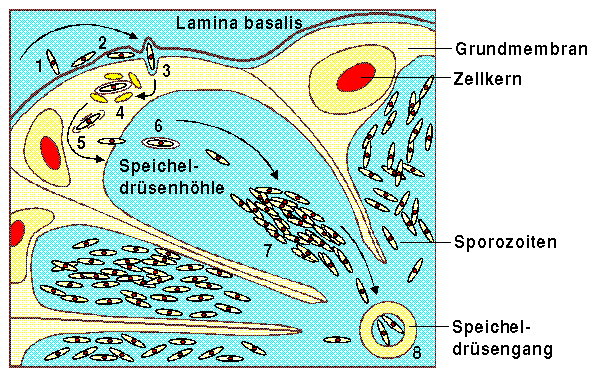
Invasion der Speicheldrüsen [nach Sherman,
1998, S. 55]
Zurück zur Orientierung "Lebenszyklus"
Sporozoiten sind in der Lage für Tage oder Wochen in den Speicheldrüsen der befallenen Anophelesmücken zu überleben, d.h. während der ganzen Lebensspanne des Vektors, ohne die Fähigkeit zu verlieren, die Leberzellen eines Menschen zu erkennen, nachdem sie durch das Blutsaugen der Stechmücke in dessen Blutkreislauf gelangten.
Studien an kultivierten Plasmodium falciparum-Sporozoiten haben gezeigt, dass diese bei einer Temperatur von 27° C bis zu 30 Tage überleben können, ohne ihre Beweglichkeit zu verlieren oder von Bakterien befallen zu werden.
Das Ansteckungspotential der Sporozoiten ist entwicklungs- und zeitabhängig: Sporozoiten aus der Oozyste sind weit weniger infektiös als diejenigen aus den Speicheldrüsen. Dabei scheint dem CS-Protein eine zentrale Rolle zuzukommen. Auch die Konzentration an TRAP scheint vom Oozystenstadium bis hin zum reifen Sporozoiten in der Speicheldrüse stetig zuzunehmen. Zudem scheinen Sporozoiten aus Stechmücken die eine hohe Gesamtzahl von Parasiten aufweisen eine höhere Infektivität aufzuweisen. [Sherman, 1998, S. 56]
Zurück zur Orientierung "Lebenszyklus"
Die Anzahl der bei eine Infektion in den Blutkreislauf gelangenden Sporozoiten scheint einen Einfluss auf die Latenzzeit, die Dauer und den Grad der Krankheit, sowie die Rückfalltendenz zu haben.
Die Gesamtzahl der Sporozoiten in auf natürlichem oder künstlichen Weg infizierten Anophelesmücken schwanken stark von weniger als 10 bis zu 100'000 Sporozoiten. Infizierte Anophelesmücken tragen normalerweise mehr als 1'000 Sporozoiten in ihren Speicheldrüsen. Durchschnittlich werden weniger als 25 Sporozoiten im Laufe einer Blutmahlzeit auf den Zwischenwirt übertragen, aber 5 - 10% der Anophelesmücken übertragen mehr als 100 Sporozoiten. Die Auswirkungen von solchen Infektionen mit erhöhter Sporozoitenzahl sind nicht bekannt.
Nach dem Blutsaugen der Anophelesmücken bleiben die Sporozoiten 5 bis 15 Minuten im Gewebe nahe der "Einstichstelle". Dieses Verhalten ist eine Folge der besonderen Form der Nahrungsaufnahme der Anophelesmücken. Diese zapft nicht etwa ein Blutgefäss an, sondern verursacht durch das Vordringen der Mundwerkzeuge in der Haut des Opfers eine winzige Blutung, aus welcher das zur Stoppung der Blutgerinnung mit Speichel vermischte Blut dann abgesaugt wird. Das Einbringen des Speichels und damit der Sporozoiten findet also während der Suche nach einer Blutquelle und vor der eigentlichen Blutaufnahme statt. Vermutlich dient die Verweildauer an der "Einstichstelle", d.h. ausserhalb des Blutstroms, dem Parasiten dazu, möglichen Abwehrreaktion des Wirtes zu entgehen. [Sherman, 1998, S. 57]
Zurück zur Orientierung "Lebenszyklus"
Wenn ein Malariaparasit nach einer Blutmahlzeit einer Anophelesmücken in den Zwischenwirt Mensch eindringt, stösst er auf eine Umgebung, die sich wesentlich von den Bedingungen in der Stechmücke unterscheidet. Nach den Eindringen der Sporozoiten in die Leber vermehrt sich der Parasit (Leberschizont) und tritt in der Form von zahlreichen Merozoiten erneut in den Blutstrom ein, wo er zur weiteren Vermehrung die Erythrozyten befällt. Nach einigen Vermehrungszyklen treten Geschlechtsformen auf, die sogenannten Gametozyten, die in der Lage sind, erneut Anophelesmücken zu infizieren und auf diese Weise den Kreislauf zu schliessen.
Zurück zur Orientierung "Lebenszyklus"
Kurz nach dem Einritt in den Blutkreislauf dringen die Sporozoiten in die Leberzellen des Menschen ein. Geschwindigkeit und Selektivität dieses Vorgangs weisen darauf hin, dass der Parasit spezielle Oberflächenproteine nutzt, um an Moleküle der Wirtszelle anzubinden. Das Eindringen eines einzigen Sporozoiten in eine Leberzelle (Hepatozyt) genügt, um eine Malariaerkrankung auszulösen. [Sherman, 1998, S. 73, 86] Bei Plasmodium falciparum und Plasmodium vivax wird davon ausgegangen, dass 10 in den Blutstrom gelangte Sporozoiten genügen, um sicher zu einer Infektion zu führen. [WHO, 1987, S. 49]
Zurück zur Orientierung "Lebenszyklus"
Malariasporozoiten werden durch die Blutzirkulation in die Leber transportiert, wo sie durch die dort herrschende Mikrozirkulation in Kontakt mit dem sinusoidalen Zellschicht, bestehend aus Endothelzellen und Kupfferzellen — den stationären Phagozyten der Leber — geraten. Diese Zellen trennen die Sporozoiten von ihrem endgültigen Ziel, den Hepatozyten, zu denen die Sporozoiten keinen direkten Zugang vom Blut aus haben.
Weder der genaue Invasionsweg der Sporozoiten zu den Hepatozyten, noch wie sie die sinusoidalen Zellschichten und die Lamina basalis durchqueren, ist bekannt. Das sinusoidale Leberendothel ist zwar von zahlreichen Poren durchzogen, deren Durchmesser bei normalem Blutdruck aber weniger als 0.1 µm beträgt. Diese Poren erlauben löslichen Proteinen und anderen kleinen Partikeln einen freien Zugang zum Disse-Raum, wo sie durch Reaktionen mit heparan sulfate proteoglycans (HSPGs) eingefangen werden. Malariasporozoiten, mit einem Durchmesser von rund 1 µm, sind für diese Endothelporen jedoch bei weitem zu gross. Aus diesem Grund wird vermutet, dass die Parasiten von den Kupfferzellen phagozytiert werden und durch diese Zugang zu ihren Zielzellen erlangen.
Innerhalb der Lebersinusoide findet sich der von CS-Protein bedeckte Sporozoit in einer Blutzirkulation, die zahlreiche Nährstoffe, Abbauprodukte von Bakterien, Zytokine und einen aussergewöhnlich hohen CO2 Gehalt von 8.5% aufweist. [Sherman, 1998, S. 73-74]
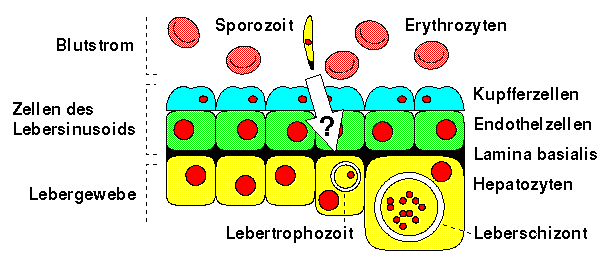
Invasion des Sporozoiten in die Leberzellen [nach Beschreibung
Sherman, 1998, S. 73-79]
Zurück zur Orientierung "Lebenszyklus"
Dem CS-Protein von Plasmodium falciparum werden ein Reihe von für den Lebenszyklus des Parasiten wichtige Eigenschaften und Funktionen zugeschrieben: Sowohl beim Eindringen in die Speicheldrüsen der Anophelesmücke als auch bei der Erkennung und Invasion der menschlichen Leberzellen, sowie der Fortbewegung scheint es eine Rolle zu spielen.
Zurück zur Orientierung "Lebenszyklus"
Mehrere Tage bevor sich die Sporozoiten formen, wird das CS-Protein erstmal im endoplasmatischen Retikulum der sich im Mitteldarm der Anophelesmücke entwickelnden Oozyste synthetisiert, von wo es an die Oberfläche der knospenden Parasiten gelangt. Die reifen Oozysten hingegen scheinen kein CS-Protein mehr zu produzieren. An der Oberfläche des Sporozoiten kann das CS-Protein aber von der Knospung über die Wanderung zum Hämozöl der Anophelesmücke, dem Eindringen in die Speicheldrüsen, wo die Eigenproduktion des Sporozoiten von CS-Protein in den Mikronemen und Rhoptrien einsetzt, die Invasion der Leber des Säugetierwirts, bis zur Ausdifferenzierung der Merozoiten im Leberschizonten, nachgewiesen werden. Wahrscheinlich benötigen die Zellorganellen des Sporozoiten nach der Trennung von der Oozyste einige Zeit, um ihre Funktion wieder aufzunehmen. [Sherman, 1998, S. 75, 86]
Zurück zur Orientierung "Lebenszyklus"
In der Leber interagiert das CS-Protein mit HSPGs an der basolateralen Oberfläche des Hepatozyten mit verschiedenen anderen Wirtsrezeptoren. Die Malariasporozoiten scheinen also, wie andere Parasiten, Bakterien und Viren auch, HSPGs für die Erkennung möglicher Wirtszellen zu benutzen, ein Eindringen wird aber erst durch zusätzliche Rezeptoren ermöglicht, zu denen wahrscheinlich das low-density lipoprotein-related protein (LPR) zählt. LPR, ein Mitglied der Endozytose-Rezeptorenfamilie, ist ein in der Evolution weitgehend unverändert auftretender, äusserst wirksamer Rezeptor, der an der Aufnahme und dem anschliessedem lysosomalen Abbau zahlreicher Proteine beteiligt ist. [Sherman, 1998, S. 76-78]
Die spezifische Anbindung des CS-Protein an die HSPGs der Leberzellen erfolgt trotz des Vorhandenseins von HSPGs in den meisten anderen Zelltypen. Dies kann durch die besondere Zusammensetzung der Glykosaminoglykane der Leber erklärt werden, die einen ungewöhnlich hohen Anteil an Sulfationen (SO4-) aufweisen. Die Bindung von Plasmodium falciparum-CS-Protein schützt Heparansulfat gegen den Abbau durch Heparinase (wirkt spezifisch auf hochsulfathaltige heparinähnliche Oligosaccharide) nicht jedoch vor Heparitinase (bewirkt den Abbau von normalem Heparansulfat).
Neueste Forschungen lassen vermuten, dass die CS-Protein-bindenden HSPGs im Disse-Raum Teil einer universellen Reinigungsfunktion der Leber sind. Eine grosse Anzahl verschiedener Proteine und gewisse Lipoproteine werden dadurch aus dem Blutstrom der Leber entfernt und durch die Hepatozyten aufgenommen und metabolisiert. Die Bindung der Sporozoiten an die Hepatozyten scheint also über eine Anbindung des CS-Proteins an die Proteoglykane der Leberzellen zu erfolgen. [Sherman, 1998, S. 78]
Möglicherweise nutzen die Sporozoiten die Kupfferzellen, die im Gegensatz zu den Hepatozyten dem sinusoidalen Lumen direkt ausgesetzt sind und von den Parasiten leicht erkannt werden können, als Tor zu ihren Zielzellen. Wenn dem so ist, werden die Sporozoiten wahrscheinlich nicht nur einfach von den Kupfferzellen durch Phagozytosis aufgenommen, sondern nutzen die Wechselwirkungen zwischen CS-Protein und den zellspezifischen Glykosaminoglykanen und LPR der Kupfferzellen, um den Lebersinusoid aktiv zu verlassen und zu den Hepatozyten zu wandern. [Sherman, 1998, S. 79]
Zurück zur Orientierung "Lebenszyklus"
Da es erst seit kurzer Zeit möglich ist, die Leberstadien von Plasmodium falciparum im Labor zu züchten, ist über den Leberschizonten und seinen Stoffwechsel nur wenig bekannt. Die Entwicklung des Sporozoiten zum Leberschizonten scheint aber derjenigen des Merozoiten zum Blutschizonten zu ähneln.
Bei der Einnistung in die Leberzelle scheint das erwähnte CS-Protein eine weitere Funktion auszüben. Während in Kupfferzellen gefundene Sporozoiten durch eine durch den Parasiten erzeugte Vakuolenmembran vor dem Zytosol des Phagozyten geschützt sind, ist eine solche Membran im frisch befallenen Hepatozyt nicht feststellbar. In einem späteren Stadium ist der heranreifende Schizont jedoch von einer Membran umgeben. Bei einer genaueren Untersuchung wurde festgestellt, dass das CS-Protein mit RNase-sensitiven Stellen des endoplasmatischen Retikulums interagiert und so eine Proteinsynthese der Wirtszelle unterbindet. [Sherman, 1998, S. 80]
Nach der Ausbildung der parasitophoren Vakuole, formt der Parasit, dort wo die innere Pellikula der Wirtszelle unterbrochen ist, eine Ausstülpung. Dann nimmt er eine kugelförmige Gestalt mit einem Durchmesser von 2.5 µm an, indem er den vorderen und hinteren Zellteil "resorbiert". In diesem Stadium kann sich der Parasit in zwei Richtungen weiterentwickeln. Bei Plasmodium falciparum und Plasmodium malariae entstehen aus allen Schizonten gleichzeitig Merozoiten. Bei Plasmodium ovale und Plasmodium vivax ist dies nicht der Fall: Ein Teil der Schizonten entwickelt sich sofort, die anderen Schizonten machen als Hypnozoit ein Ruhestadium durch. Diese Hypnozoiten werden zu unterschiedlichen Zeiten aktiv. Während bei Plasmodium vivax verschiedene Stämme bekannt sind, die eine unterschiedlich lange Ruhephase aufweisen, ist über das Ruhestadium von Plasmodium ovale nichts bekannt. [WHO, 1987, S. 15, 18-19]
Die Entwicklung des Schizonten hin zur Bildung der Merozoiten beginnt mit einer Grössenzunahmen auf bis zu 30 - 70 µm. Mit dem Einsetzten der ersten Zellteilung verschwindet die Membran der Pellikula und die subpellikulären Mikrotubuli. Die Zellkernteilung wird durch eine einzige Spindel des kleinen Zellkernes eingeleitet. Der Kern teilt sich in zahlreiche kleine Kerne auf und die Zellorganellen vermehren sich. Im reiferen Schizonten wird das Zellplasma unter Vereinigung von peripheren Vakuolen, wahrscheinlich durch eine Membranzunahme des endoplasmatischen Retikulums in mehrere Pseudozytomere aufgeteilt. Von dieser vergrösserten Oberfläche knospen die sich neu bildenden Merozoiten. Je nach Art bilden sich dabei pro Schizont 2000 (bei Plasmodium malariae) bis 30'000 (bei Plasmodium falciparum) Merozoiten. Zur Zeit der Freilassung der Merozoiten, zerfällt die parasitophore Vakuole und die Zerstörung des Hepatozytenplasmalemmas entlässt die Merozoiten in den Blutstrom. Die Reste des Schizonten werden von phagozytierenden Zellen vernichtet. [Kayser, 1998, S. 531; WHO, 1987, S. 52, 177]
Unterdessen gilt als gesichert, dass die Merozoiten derjenigen Plasmodien, welche Säugetiere befallen, nur in Erythrozyten eindringen können. Im Gegensatz dazu kann die erste Merozoitengenerartion von Malariaparasiten in Vögeln sich nur in Gewebezellen vermehren. Aus diesem Grund kommt es in der Vogelmalaria erst bei ab der zweiten Merozoitengeneration zur Invasion der Vogelerythrozyten. [WHO, 1987, S. 53; Sherman, 1998, S. 515]
Bereits während des Leberstadiums einer Malariainfektion, bevor die Merozoiten in den Blutstrom entlassen werden lassen sich Veränderungen an der Zellmembran der Erythrozyten feststellen. Die dafür zugrundeliegenden Mechanismen sind jedoch unbekannt. [Sherman, 1998, S. 168]
Zurück zur Orientierung "Lebenszyklus"
Alle durch die Malaria hervorgerufenen klinischen Symptome und krankhaften Veränderungen werden durch die asexuelle, erythrozytäre Phase des Plasmodium-Lebenszyklus hervorgerufen. Diese wird durch die Freisetzung tausender Merozoiten aus den herangereiften Leberschizonten in den Hepatozyten eingeleitet. Die Merozoiten dringen in die Erythrozyten ein, entwickeln sich weiter zu Trophozoiten und zu viele Zellkerne enthaltende Blutschizonten. Wenn der Erythrozyt zerreisst, drängen neugebildete Merozoiten in den Blutkreislauf, die weitere Erythrozyten infizieren können.
Dieser Kreislauf von Neuinfektion der Erythrozyten ist für die Vollendung des Lebenszyklus der Malariaerreger von grosser Bedeutung: Nach wenigen dieser Blutinfektionen entwickeln sich einige Merozoiten weiter zu Gametozyten, die für eine Neuinfektion einer Stechmücke notwendigen geschlechtlichen Formen des Parasiten. Die Ursachen die von einer Entwicklung weg vom Blutschizonten hin zu Gametozyten führen sind nicht bekannt, aber wenn eine weibliche Anophelesmücke Gametozyten in ihrer Blutmahlzeit aufnimmt, kommt es zur Gametogenesis, Befruchtung, und schlussendlich zur Freisetzung von Sporozoiten, wodurch ein neuer Mensch-Stechmücken-Infektionszyklus beginnen kann.
Da sich die Merozoiten der einzelnen Plasmodienarten bezüglich ihrer Anbindungsmechanismen an die Erythrozyten und ihren biologischen Eigenschaften unterscheiden, wurden Merozoiten verschiedener Erreger untersucht. Was über die Biologie der Merozoiten bekannt ist, basiert weitgehend auf dem Studium von Plasmodium berghei, einem Malariaerreger in Affen, und dem einfach in Kulturen zu haltendem wichtigsten menschlichen Malariaerreger Plasmodium falciparum. [Sherman, 1998, S. 93]
Zurück zur Orientierung "Lebenszyklus"
Merozoiten sind schmale, eiförmige, je nach Spezies 1.5 bis 2.5 µm lange und 1.0 bis 2.0 µm breite Zellen. Das hintere Ende der Zelle ist etwas breiter ausgeformt als der den apikalen Pol enthaltende Teil, der sich durch eine konische Ausbuchtung auszeichnet. Merozoiten verfügen über die grundsätzlichen Bestandteile aller eukaryotischen Zellen: Zellkern, Chromosomen, Mitochondrien, endoplasmatisches Retikulum, Golgiapparat, Ribosomen usw.
Der Zellkern liegt im hinteren breiteren Teil der Zelle und enthält an die Zellkernmembran geklumptes Chromatin, während das Kernplasma von locker gestreuten kleinen Partikeln und feinen Fibrillen durchsetzt ist.
Im zentralen Teil des Merozoiten liegt ein Mitochondrium, dessen innere Membran wenige durch fingerartige Einstülpungen geformte Cristae aufweist.
Zahlreiche Ribosomen finden sich im Zellplasma, dagegen kann nur wenig endoplasmatisches Retikulum beobachtet werden und auch der Golgiapparat ist nur wenig ausgeprägt. [Sherman, 1998, S. 94, 123]
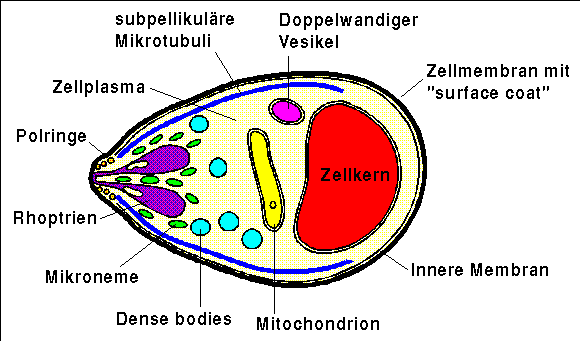
Struktur eines Merozoiten [nach Mehlhorn,
1998, S. 125; Sherman, 1998, S.
124]
Zurück zur Orientierung "Lebenszyklus"
Darüber hinaus verfügen Merozoiten aber über eine Reihe von speziellen Organellen, die ihnen das Eindringen in Erythrozyten erleichtern. Zwei auffallende birnenförmige Organellen, die Rhoptrien, und verschiedene schlanke röhrenförmige Organe, Mikronemen genannt, finden sich am apikalen Ende der Zelle und formen zusammen mit anderen Strukturen den sogenannten apikalen Komplex. Der apikale Komplex erlaubt dem Merozoiten das Eindringen in den Erythrozyten.
Die Rhoptrien sind zwei elektronendichte, membrangebundene Körperchen von 570 nm Länge und 330 nm Breite, die eine granuläre Matrix enthalten und durch einen zweigeteilte Röhre mit einer Öffnung im Zentrum der apikalen Ausbuchtung, der "Kappe" des Merozoiten, verbunden sind.
Die Mikronemen weisen ebenfalls eine hohe Elektronendichte auf und sind mit einem granulären Material gefüllt, es handelt sich bei ihnen aber um röhrenförmige, 100 nm lange und 40 nm breite Vesikel, welche den gemeinsamen Kanal der in Paaren auftretenden Rhoptrien umgeben. Zudem reichen sie tiefer in die apikale Zone des Merozoiten.
Sowohl Mikronemen als auch Rhoptrien enthalten eine Reihe von Proteinen, die zum Teil experimentell nachgewiesene, zum Teil vermutete Rollen beim Eindringen in den Erythrozyten innehaben. Bei Plasmodium vivax enthalten die Mikronemen die Duffy-bindende Liganden.
Weiter fallen drei polare Ringe in der apikalen Erhebung auf, die wahrscheinlich aus dem Zellskelett der Zelle gebildet werden. [Sherman, 1998, S. 94, 123]
Zurück zur Orientierung "Lebenszyklus"
Zudem enthalten Merozoiten zahlreiche sogenannte Mikrosphären, kleine, 140 mal 120 nm messende, membrangebundene kugelförmige Vesikel, die "dense bodies". Wie ihr englischer Name vermuten lässt, weisen diese Organellen eine grosse Elektronendichte auf und sind wie die Rhoptrien mit einer granulären Matrix angefüllt, finden sich aber im Gegensatz zu den Rhoptrien und den Mikronemen über das Zellplasma des gesamten Merozoiten verteilt. Die Mikrosphären spielen einen Part in einer späten Phase der Invasion von Erythrozyten und partizipieren in der Ausdifferenzierung des Merozoiten in den wachsenden Trophozoiten. [Sherman, 1998, S. 94, 123]
Zurück zur Orientierung "Lebenszyklus"
Die 7.5 nm dicke Plasmamembran des extrazellulären Merozoiten gleicht derjenigen anderer eukaryotischer Zellen und enthält wie diese zahlreiche Partikel. Unter der Plasmamembran, ausgenommen der Region des apikalen Komplexes, finden sich zwei weitere, zusammen 15 nm dicke Membranen, welche eine abgeflachte Zisterne bilden. Diese zwei Membranen scheinen durch Filamente mit der Plasmamembran verbunden zu sein und formen mit dieser zusammen die für den Merozoiten typische dreifache Membran: die Pellikula.
Auch eine Reihe von Mikrotubuli, die am untersten der apikalen Polarringe festgemacht sind, scheinen durch verstreute Filamente mit der Pellikula verbunden zu sein. Dieses rudimentäre Netz von Mikrotubuli strahlt nach hinten unter der Pellikula bis zur Hälfte oder zwei Dritteln der Länge des Merozoiten aus. [Sherman, 1998, S. 94, 123]
Über der Plasmamembran des Merozoiten findet sich ein strukturierter "surface coat". Die Ultrastruktur dieses "surface coat" ist bei Plasmodium knowlesie, einem Malariaparasiten von Primaten, am besten untersucht worden. Der gesamte "surface coat", der auch die apikalen Erhebung bedeckt, besteht aus Fibrillenbüscheln, die eng zusammenliegend ein netzähnliches Muster bilden. Jedes dieser Büschel besteht aus 5 bis 10 parallel gelegenen Filamenten, die 2 bis 3 nm dick und 18 bis 22 nm lang, und deren Enden verdickt oder aufgespaltet sind. Dünnere weit weniger zahlreiche Filamente von mehr als 40 nm Länge stehen ebenfalls vom "suface coat" ab oder liegen parallel zu diesem. Zwischen den Filamentbüscheln scheint die Hülle von einer amorphen proteinartigen Schicht überzogen zu sein.
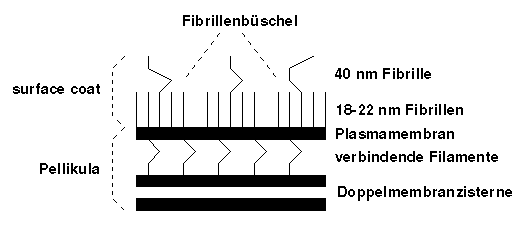
Oberflächenstruktur des Merozoiten [nach Sherman,
1998, S. 95]
Der Aufbau und die Organisation der Oberflächenhülle von Plasmodium knowlesie findet von der frühen Schizogonie über die Segmentation des Schizonten bis hin zur Ausdifferenzierung der Merozoiten (Merogonie) statt. Ähnliche Hüllenstrukturen finden sich auch bei Plasmodium falciparum und Plasmodium vivax. Bei Plasmodium vivax, dessen Merozoiten besonders rund sind, erscheinen die Fibrillenbüschel palisadenartig und ragen wie Spitzen aus der Oberfläche. Der fertige fädige "surface coat" spielt eine wichtige Rolle in den frühen Stadien der Invasion des Merozoiten in den Erythrozyten. [Sherman, 1998, S. 94-95]
Zurück zur Orientierung "Lebenszyklus"
Wenn die Merozoiten die verbrauchten Hepatozyten oder Erythrozyten verlassen, treten sie in die schnelle Welt der Blutzirkulation ein. Ausserzelluläre Merozoiten sind äusserst kurzlebig und müssen möglichst rasch an einen Erythrozyten anbinden. Für Malariaerregerarten, die Erythrozyten aller Reifestufe befallen, ist es wahrscheinlich kein Problem, eine neue Wirtszelle zu finden, bedenkt man die hohe Erythrozytenzahl im Blut und deren raschen Durchfluss. Die im Sporozoiten beobachtete "gliding motility", die eigenständige Bewegung, dürfte für das Zusammentreffen zwischen Merozoit und Erythrozyt keine notwenige Voraussetzung sein.
Plasmodium vivax und Plasmodium ovale befallen jedoch ausschliesslich Retikulozyten, d.h. junge Erythrozyten, die weniger als 1% der gesamten Erythrozytenpopulation ausmachen. Für diese Arten scheint das Auffinden einer geeigneten Wirtszelle weit schwieriger zu sein. Plasmodium malariae hingegen bevorzugt alte Erythrozyten, während Plasmodium falciparum Erythrozyten aller Reifungsstufen befällt.
Ist eine geeignete Wirtszelle einmal identifiziert, dringt der Merozoit innerhalb von 30 bis 60 Sekunden in den Erythrozyten ein und bracht dann rund 10 bis 20 Minuten um sich in den intrazellulären Trophozoiten zu verwandeln.
Das Eindringen des Merozoiten in den Erythrozyten kann in drei klar unterscheidbare Phasen aufgeteilt werden, die von verschiedenen Veränderungen der Ultrastruktur der Parasitenzelle und verschiedenen molekularen Ereignissen begleitet werden:
Die erste Phase der Invasion in den Erythrozyten involviert die Erkennung der potentiellen Wirtszelle und die erfolgreiche apikale Anbindung. In der zweiten Phase dringt der dringt der Parasit in die Wirtszelle ein, wo er sich innerhalb des Wirtszellplasmas in einer Vakuole einnistet. Die dritte und letzte Phase wird durch die vom Parasiten eingeleiteten Veränderung innerhalb der Wirtszelle und der Entwicklung hin zum Trophozoiten charakterisiert. [Sherman, 1998, S. 95-96]
Zurück zur Orientierung "Lebenszyklus"
Der erste Kontakt zwischen dem Merozoiten und dem Erythrozyten kann an einer beliebigen Stelle der Oberfläche des Merozoiten erfolgen. Dabei spielt der "surface coat" des Angreifers eine wichtige Rolle: Ein Kontakt der Filamente des Merozoiten-surface-coat zum Erythrozyten wurde über Distanzen von 15 bis 20 nm und über längere Distanzen von mehr als 40 nm beobachtet. In diesem Stadium kann sich der Merozoit wieder aus der Bindung zum Erythrozyten lösen und eine Verbindung mit einer anderen Wirtszelle eingehen. Falls der apikale Pol des Merozoiten nicht in Richtung der Erythrozytenoberfläche zeigt, was häufig vorkommt, muss sich der Merozoit neu ausrichten. Die Bewegungen der Erythrozytenmembran scheinen diese Neuausrichtung des Merozoiten zu erleichtern.
Die Ausrichtung der apikalen Erhebung zur Oberfläche des Erythrozyten ist eine notwendige Voraussetzung für den nächsten Schritt, der eine engere, aus weniger als 4 nm Distanz folgende Membranverbindung zwischen den beiden Zellen einleitet, die sogenannte "tight junction".
Diese "enge Verbindung" wird durch eine Elektronenkonzentration unter der Erythrozytenoberfläche charakterisiert und von einer Einbuchtung der Erythrozytenoberfläche begleitet, in welche die apikale Erhebung des Merozoiten zu liegen kommt. Der Merozoit ist nun bereit für das Eindringen in die Wirtszelle. Ungleich dem ersten Kontakt des Merozoiten mit dem Erythrozyten ist die "enge Verbindung" nicht reversibel. [Sherman, 1998, S. 96]
Im Gegensatz zu den noch nicht eindeutig bestimmten Molekülen, die den Erstkontakt zwischen Merozoit und Erythrozyt einleiten, sind die für die "enge Verbindung" verantwortlichen Liganden des Merozoiten und die Rezeptoren des Erythrozyten besser bekannt. Für Plasmodium vivax ist das Oberflächenglykoprotein des Erythrozyten, welches die Duffy-Blutgruppenantigene Fya, Fyb und Fy6 trägt ein zwingend notwendiger Rezeptor. Plasmodium vivax ist nicht in der Lage, in menschliche Erythrozyten einzudringen, welchen das Duffy-Glykoprotein fehlen, d.h. Duffy-negativ (FyFy) sind. [Sherman, 1998, S. 99]
Das Duffy-Glykoprotein findet sich an den Oberflächen aller Erythrozyten und eine enge Bindung des Duffy binding protein (DBP) des Merozoiten an den Glykoproteinrezeptor eines Erythrozyten der kein Retikulozyt ist könnte fatale Folgen für den Plasmodium vivax-Merozoiten haben. Plasmodium vivax muss also für das Auffinden einer geeigneten Wirtszelle über zusätzliche Erkennungsmöglichkeiten verfügen, die Gegenstand der aktuellen Forschung sind. [Sherman, 1998, S. 103]
Weitere Untersuchungen zur Anbindung an Duffy-Glykoproteine haben ergeben, dass Plasmodium falciparum-Merozoiten Sialinsäurereste an den Membranglykophorinen an Stelle der Duffy-Glykoproteine als Hauptinvasionsfaktor benutzen. Aus diesem Grund befallen Plasmodium falciparum-Merozoiten Erythrozyten unabhängig davon, ob diese Duffy-positiv oder Duffy-negativ sind. [Sherman, 1998, S. 100]
Eine Reihe von Studien und Beobachtungen weisen darauf hin, dass Merozoiten mehr als einen Protein-"Schlüssel" besitzen — die möglicherweise in den Rhoptrien gebildet oder zumindest gespeichert werden —, um die "Schlösser" des Erythrozyten zu knacken. Abgesehen von Sialinsäure und Glykophorin A scheinen eine Reihe von weiteren Proteinen den Merozoiten zur Anbindung an den Erythrozyten zu befähigen. Für Plasmodium falciparum existieren mindestens drei weitere mögliche Mechanismen. Es wird vermutet, dass Plasmodium falciparum dadurch einen evolutionären Vorteil gegenüber Veränderungen von Rezeptoren an der Oberfläche der Erythrozyten hat. Und genetisch bedingte Veränderungen der Struktur oder der Expression von erythrozytären Glykoproteinen sind beim Menschen nicht selten und bleiben für diesen meist ohne schwerwiegende Folgen. Unter diesen Umständen ist es erstaunlich, dass Plasmodium falciparum in vielen Gebieten Afrikas, Teilen Südasiens und in Neuguinea noch immer hoch endemisch ist. Zusätzlich könnte die Ausnutzung alternativer Bindungsmechanismen auch einen selektiven Vorteil im Bezug auf natürlich erworbenen Abwehrreaktionen gegenüber Merozoitenrezeptoren bilden. [Sherman, 1998, S. 104-105]
Im Gegensatz zur weiten Verbreitung von Plasmodium falciparum in grossen Teilen des westlichen und zentralen Afrikas, fehlt der auf die Duffy-Antigene angewiesene Erreger Plasmodium vivax in diesen Gebieten fast vollständig, da die grosse Mehrheit der einheimischen Bevölkerung Duffy-negativ ist. [Sherman, 1998, S. 105]
Hat der Merozoit erst einmal eine "enge Verbindung" mit dem Erythrozyten erreicht, kann er zur zweiten Phase der Invasion übergehen. Diese involviert eine Reihe von molekularen Vorgängen, die es dem Merozoiten ermöglichen in den Erythrozyten einzudringen und sich innerhalb einer von einer Fettmembran umgebenen Vakuole einzuhüllen. Folgende Vorgänge spielen sich dabei ab: Die Verbindungsstelle zwischen dem Merozoiten und dem Erythrozyten wandert in Richtung des rückwärtigen Endes des Merozoiten, wodurch der Merozoit eingehüllt wird (1). Der Merozoit schütten den Inhalt der Rhoptrien aus (2). Die Membranarchitektur und die Proteine des Zellskeletts des Erythrozyten werden örtlich verändert (3). Die Erythrozytenmembran stülpt sich ein während die parasitophore Vakuolenmembran (PVM) und die parasitophore Vakuole (PV) gebildet wird. Gleichzeitig scheint der Merozoit seine Oberflächenhülle zu verlieren (4). Letztlich schliessen sich die Erythrozyten- und die PV-Membran. Da der Erythrozyt weder zur Phagozytosis noch zu einer von Rezeptoren eingeleiteten Endozytosis fähig ist, müssen diese Vorgänge grösstenteils vom Merozoiten gesteuert werden. Die Energie für diesen Vorgang stammt wahrscheinlich ebenfalls zu einem grossen Teil vom Merozoiten. [Sherman, 1998, S. 106-109]
Einmal vollständig in die neue Wirtszelle eingedrungen, ist der Merozoit vollständig von der PVM umgeben, wobei die Verbindung zur Wirtszelle am hinteren Ende des Parasiten noch für eine Weile bestehen bleibt. In diesem Stadium wandern die ursprünglich über das gesamte Zellplasma zerstreuten Mikrosphären ("dense bodies") zur Plasmamembran des Merozoiten und fusionieren mit dieser. Dadurch wird der granuläre, noch nicht bekannte Inhalt der Mikrosphären in die PV ausgeschüttet, was oft eine Störung der PVM zur Folge hat. Gleichzeitig lässt sich eine Abflachung des Merozoiten beobachten und die Transformation zum im Lichtmikroskop ringförmig erscheinenden Trophozoiten, der sich vom Hämoglobin des Erythrozyten ernährt, setzt ein. [Sherman, 1998, S. 112]
Die erythrozytären Stadien des Malariaparasiten sind in der Lage, morphologische und funktionelle Änderungen in den infizierten Erythrozyten zu bewirken, wahrscheinlich um sich selbst mit benötigten Nährstoffen zu versorgen. Einige dieser Veränderungen scheinen mit zum Krankheitsbild der Malaria beizutragen, ihre Bedeutung ist aber noch nicht vollkommen klar. [Sherman, 1998, S. 123]

Invasion des Merozoiten in den Erythrozyten [nach Mehlhorn,
1998, S. 125]
Zurück zur Orientierung "Lebenszyklus"
Nachdem der länglich gekrümmte Merozoit in den Erythrozyten eingedrungen ist, nimmt er zunehmend runde Gestalt an und wandelt sich zum Trophozoiten, welcher sich vom Hämoglobin der Wirtszelle ernährt.
Der Zellkern des Trophozoiten enthält feingranuläres und fädiges Chromatinmaterial. Das Vorhandensein von Euchromatin im Kern des Trophozoiten lässt vermuten, dass der Zellkern metabolisch aktiv ist. In vielen Malariaparasiten fehlt der Nukleolus.
Im Zellplasma finden sich mehrere Mitochondrien, die bei Plasmodium falciparum nur wenige oder gar keine Cristae aufweisen, sowie zahlreiche zumeist freie Ribosomen. Vorhandene Polyribosomen bestehen meist aus 4 bis 6 linear aufgereihten Monomeren. Das endoplasmatische Retikulum ist spärlich vorhanden und besteht aus kleinen Vesikeln oder kurzen Kanälchen entlang den Ribosomen. Der unauffällige Golgiapparat, bestehend aus kleinen Vesikeln und ist lose mit dem endoplasmatischen Retikulum verbunden. [Sherman, 1998, S. 127]
Zurück zur Orientierung "Lebenszyklus"
Im Erythrozyten erfährt der sich entwickelnde Trophozoit, aufgrund des raschen Abbaus der inneren Membrankomplexe und der unter der Pellikula liegenden Mikrotubuli, eine Gestaltänderung. Nach dem völligen Abbau dieser inneren Strukturen wird der Parasit nur noch durch die Plasmamembran begrenzt und liegt innerhalb der parasitophoren Vakuolenmembran (PVM). Die apikalen Organe, wie Polarringe, Rhoptrien und Mikronemen werden ebenfalls abgebaut.
Mit zunehmender Grösse nimmt der Trophozoit infolge der fehlenden festigenden Pellikula eine unregelmässige Form an. Einige Trophozoiten, besonders diejenigen im Menschen und anderen Primaten, zeigen gewundene Aus- und Einbuchtungen des Zellplasmas. Die im Mikroskop beobachtete, typische Ringform des jungen Trophozoiten ist eine Folge dieser Zellplasmaverformungen und tritt bei Plasmodium falciparum 20-24 Stunden nach der Invasion des Erythrozyten ein. [Sherman, 1998, S. 126; STI, 1998, S. 17]
Der Trophozoit nimmt das Zellplasma der Wirtszelle durch eine kreisförmige Struktur, dem Zytostom, entlang der Plasmamembran gelegen, auf. Das Zellplasma der Wirtszelle gelangt in den zystostomalen Hohlraum und wird in Form einer Ausbuchtung an der zytostomalen Öffnung, mit einem Durchmesser von 40 bis 100 nm, zusammen mit der zystostomalen Membran abgeschnitten, wodurch eine Nahrungsvakuole im Zellplasma des Parasiten entsteht. Die Verdauung des Hämoglobins erfolgt in der Nahrungsvakuole. Während des Hämoglobinabbaus wird das freigesetzte Häm zu Hämozoin (dem Malariapigment) polimerisiert und in der Nahrungsvakuole gespeichert. Die Pigmente der Säugetiermalariaerreger sind kristallin und weisen eine rechteckige Form auf. [Sherman, 1998, S. 127]
Zurück zur Orientierung "Lebenszyklus"
Bei einigen Malariaerregern wurde ruhende Parasiten (sogenannte Hypnozoiten) im Erythrozytenstadium festgestellt. Möglicherweise sind auch Plasmodium falciparum-Trophozoiten in der Lage diese Art von "Winterschlaf" zu halten, was gewisse Phänomene im Zusammenhang mit Resistenz gegen Medikamentenbehandlung erklären würde. [Sherman, 1998, S. 126]
Zurück zur Orientierung "Lebenszyklus"
Bevor Malariaparasiten sich zu geschlechtlichen, für Stechmücken ansteckende, Formen entwickeln, findet eine Vermehrung innerhalb der Erythrozyten statt, die in einem je nach Art 6 - 36 Merozoiten an den Blutstrom abgebenden Blutschizonten resultiert. Der Vorgang der Vermehrung innerhalb der Erythrozyten wird als Blutschizogonie bezeichnet. Bei allen menschlichen Erregern dauert das Stadium der Blutschizogonie ein Vielfaches von 24 Stunden: Je 48 Stunden bei Plasmodium falciparum, Plasmodium ovale und Plasmodium vivax und 72 Stunden bei Plasmodium malariae. [Kayser, 1998, S. 533f.; Sherman, 1998, S. 128]
Zurück zur Orientierung "Lebenszyklus"
Während der Blutschizogonie teilt sich der Zellkern, je nach Art des Erregers drei- bis fünfmal, und die Organellen des Zellplasmas differenzieren sich aus. Im Laufe der Zellkernteilung nimmt der Zellkern Hantelform an und ein Nukleolus erscheint in der Nähe der Zellkernverengung. Während der Teilung bleibt die Zellkernmembran, ausgenommen in der Nähe der zentriolaren Plaque, intakt.
Die Zellkernteilung wird von Veränderungen der Organellen im Zellplasma begleitet. Die Mitochondrien vergrössern sich und formen mehrere Knospen, die sich zu neuen Mitochondrien entwickeln. Gleichzeitig erscheinen verschiedene für den Merozoiten typischen Organellen wieder, die während des Trophozoitenstadiums verschwanden.
Diese Organellen umfassen zufällig verteilte Segmente der inneren Membrane der Merozoitenpellikula. Nachdem sich der innere Membrankomplex ausgeformt hat, steigt die Elektronendichte der subpellikulären Mikrotubuli- und Rhoptrienvorläufer mit zunehmender Differenzierung zum Merozoiten hin. Die von den inneren Membranen bedeckten Gebiete formen Ausbuchtungen in den Raum der parasitophoren Vakuole hinein, um neue Merozoiten zu formen, in die dann verschiedene Organellen, wie Zellkern und Mitochondrien einwandern. [Sherman, 1998, S. 128; WHO, 1987, S. 54]
Zurück zur Orientierung "Lebenszyklus"
Die erythrozytären Stadien der Malariaerreger verursachen wesentliche Änderungen in der Struktur und Funktion der infizierten Erythrozyten. Die Strukturänderungen umfassen "knobs", zytoplasmatische Spalträume, Caveolae, caveolavesikuläreren Komplexen, und die sogenannten tubovesikuläre Komplexe und werden begleitet von Proteintransporten des Parasiten zu der Membran des Erythrozyten oder dem Zellskelett. Während die Erythrozyten bei einem Befall mit Plasmodium falciparum und Plasmodium malariae normalerweise ihre Form behalten, bewirkt eine Plasmodium ovale Infektion eine Deformierung und bei Plasmodium vivax vergrössern sich die Erythrozyten und werden rundlicher.
Zurück zur Orientierung "Lebenszyklus"
Als "knobs" werden knopfförmige Ausbuchtungen hoher Elektronendichte von 30 bis 40 nm Höhe und 90 bis 100 nm Weite an der Plasmamembran des Erythrozyten bezeichnet, die sich etwa 24 - 36 Stunden nach dem Eindringen von Plasmodium falciparum in einen Erythrozyten bilden. Die an der Oberfläche der "knobs" präsentierten Antigene formen Verbindungen mit Endothelzellen und benachbarten Erythrozyten, wodurch beispielsweise Hirnkapillarien blockiert werden können. [Kayser, 1998, S. 537; Sherman, 1998, S. 128]
Zurück zur Orientierung "Lebenszyklus"
Plasmodium vivax verursacht morphologische Veränderungen an der Wirtszelle, die lichtmikroskopisch in Romanovsky-gefärbten Blutausstrichen als zahlreiche ziegelrote Punkte gesehen werden können. Diese sogenannten Schüffnerflecken spielen eine wichtige Rolle in der Identifikation von Plasmodium vivax. Sie werden durch lungenbläschenähnlichen Trauben von kleinen Vesikeln an der Basis von Einbuchtungen der Erythrozytenmembran, den Caveolavesikuläre Komplexe verursacht. [Sherman, 1998, S. 130]
Zurück zur Orientierung "Lebenszyklus"
Der intraerythrozytäre Parasit hat ein neues System zum Transport von Proteinen über seine eigene Plasmamembran, durch die Vakuolenmembran und das Zellplasma des Erythrozyten zu dessen Membran entwickelt. Diese Proteine binden sich an die Erythrozytenmembran und verändern diese wahrscheinlich zum Vorteil des Parasiten.
Von Plasmodium falciparum infizierte Erythrozyten enthalten zwei unterschiedliche Arten von membrangebundenen Spaltenräumen während des Trophozoiten- und Blutschizontenstadiums.
Die erste besteht aus grossen, runden oder länglichen Vesikeln, welche Zellplasma des Erythrozyten enthalten. Diese grossen Vesikelspalten scheinen von dünnen pseudopodialen Erweiterungen des Parasitenzytoplasmas und der parasitophoren Vakuolenmembran auszugehen. Diese Erweiterungen formen Schleifen im Erythrozytenzytoplasma, die sich vom Hauptkörper des Parasiten zu lösen scheinen.
Die zweite Art besteht aus abgeflachten, im Querschnitt schlitzähnlichen Spaltraum, mit einer Länge von 100 bis 600 nm, und korrespondieren mit dem in Lichtmikroskop beobachtbaren Mauererspalträume (Maurer's cleft). [Sherman, 1998, S. 131]
Zurück zur Orientierung "Lebenszyklus"
Während des Trophozoiten- und Blutschizontenstadiums einer Malariainfektion exportiert der Parasit Membranmaterial in das Zellplasma des Erythrozyten, sowie Lipide und Proteine zur Erythrozytenmembran, wodurch er die Wirtszelle "transformiert". Bei von Plasmodium falciparum infizierten Erythrozyten kann ein neues Netzwerk von tubovesikulären Membranen beobachtet werden, die vermutlich für den Stofftransport im Erythrozyten verantwortlich sind. [Sherman, 1998, S. 131]
Zurück zur Orientierung "Lebenszyklus"
In grossen Zügen gleicht der Kohlenhydratstoffwechsel von Plasmodium falciparum, einem mikroaerophilen Homolaktat-Fermenter, demjenigen anderer eukaryotischer Zellen.
Zurück zur Orientierung "Lebenszyklus"
Da die im Erythrozyten liegenden Stadien der Malariaerreger keine eigenen Energiereserven in der Form von Glykogen oder Lipiden aufweisen, dient ihnen die im Blutplasma vorhandene Glukose als direkter Energielieferant. Dabei verbraucht der Parasit, da er die Glukose grösstenteils zu L-Laktat fermentiert, beachtliche Mengen: Der Glukosekonsum eines infizierten Erythrozyten kann kann den Konsum einer nicht infizierten Zelle bis um das 30-100fache übersteigen. [STI, 1998, S. 18]
Zurück zur Orientierung "Lebenszyklus"
Für die Glykolyse benutzt der Parasit eigene wesentlich rascher arbeitende Enzyme, die ihren optimalen Wirkungsgrad bei einem pH unter dem Normal-pH des Erythrozyten erzielen. Der vom Parasiten benutzte Embden-Meyerhoff-Parnas (EMP) Stoffwechselpfad erwirtschaftet pro metabolisiertem Glukosemolekül einen Reingewinn von zwei ATP und produziert zwei Laktatmoleküle.
Zusätzlich zum EMP ist der Parasit in der Lage, Glucose über den pentose phosphat pathway (PPP) zu metabolisieren. Der PPP dient dazu Glukose-6-Phosphate in Ribose-5-Phosphate, die zur Synthese von nukleotidem Material gebraucht werden, zu verwandeln. Der PPP-Aktivitätsgrad ist in den meisten von Malariaparasiten befallenen Erythrozyten vergleichsweise niedrig, soll aber bei durch Plasmodium falciparum befallenen Zellen wesentlich höher liegen. Ein Grund dafür könnte im Nebenprodukt NADPH des PPP liegen, das zur Reduzierung des durch den Abbau von Hämoglobin entstehenden oxidativen Stress beitragen könnte. [Sherman, 1998, S. 135-141]
Zurück zur Orientierung "Lebenszyklus"
Da der Parasit nur über eine beschränkte Fähigkeit zur Aminosäurensynthese verfügt, ist er auf den Gewinn von Aminosäuren durch den Abbau des Hämoglobins angewiesen. Die dem Abbau von Hämoglobin und die Umwandlung des für den Parasiten giftigen Häms in Hämozoin zugrundeliegenden Mechanismen sind nur teilweise erforscht, sind aber für die Entwicklung neuer Antimalariamedikamente von grösstem Interesse. [Sherman, 1998, S. 145] Die grösste Menge an Hämoglobin wird während des Trophozoiten- und des jungen Schizontenstadiums abgebaut. [Rosenthal]
Zurück zur Orientierung "Lebenszyklus"
Die in den Erythrozyten befindlichen Stadien der Malariaparasiten nehmen grosse Mengen an Hämoglobin auf und bauen diese ab. Dazu transportiert der Parasit Erythrozytenzytosol in eine Nahrungsvakuole mit saurem pH, wo das Hämoglobin in seine Komponenten, 4 Globine (je 2 alpha- und beta-Globine) und 1 Häm, zerlegt und das Globin hydrolysiert wird.
Im jungen Trophozoitenstadium von Plasmodium falciparum vollzieht sich die Hämoglobinaufnahme über die Aufnahme von hämoglobinreichem Zytosol des Erythrozyten. Mit zunehmenden Wachstum des Parasiten nimmt auch der Bedarf an Hämoglobin zu. Trophozoiten eines weiter entwickelten Stadiums verfügen deshalb über zwei Strukturen für den Transport und den Abbau des Hämoglobins: die Nahrungsvakuole und das Zytostom. Bei der Nahrungsvakuole von Plasmodium falciparum handelt es sich wahrscheinlich um ein grosses Lysosom, in dessem sauren Milieu verschiedene Enzyme auf das Hämoglobin und vielleicht auch andere Moleküle einwirken. Viele Malariaarten besitzen im Gegensatz zu Plasmodium falciparum mehr als eine Nahrungsvakuole, ausserdem transportieren sie das Zytosol der Wirtszelle nicht mittels Vesikeln, sondern durch ein röhrenartiges Netzwerk. [Sherman, 1998, S. 145]
Zurück zur Orientierung "Lebenszyklus"
Der Abbau von Hämoglobin scheint die meisten der vom Parasiten für die eigene Proteinsynthese benötigten Aminosäuren zu liefern. Zusätzlich versorgt der Prozess den Parasiten wahrscheinlich auch mit Eisen.
Diese Schlussfolgerung stützt sich auf fünf Beobachtungen: 1. Während eines Infektionsverlaufes nimmt der Hämoglobingehalt der infizierten Erythrozyten um 25-75% ab. 2. Infizierte Erythrozyten weisen eine höhere Konzentration freier Aminosäuren als nicht befallene. 3. Die Zusammensetzung der freien Aminosäuren in infizierten Erythrozyten entspricht der Zusammensetzung von Hämoglobin. 4. Beim Befall von Erythrozyten mit radioaktiv markiertem Hämoglobin können die Marker nach einiger Zeit in vom Parasiten gebildeten Proteinen nachgewiesen werden. 5. Cyteinprotease-Inhibitoren, welche den Abbau von Hämoglobin blockieren, verhindern ein Parasitenwachstum. [Sherman, 1998, S. 146]
Zurück zur Orientierung "Lebenszyklus"
Der Malariaparasit ist in der Lage, eigenständig Glucose, Pyruvate, Acetate und CO2 in Glutamate, Apertate, Alanine und Leucine zu metabolisieren. In den Erythrozyten befindliche Plasmodium falciparum-Parasiten benötigen mindestens fünf Aminosäuren für ein normales Wachstum: Cystein, Glutamat, Glutamin, Isoleucin, Methionin. Die Abwesenheit von Isoleucin oder Methionin führt zum raschen Verfall der intraerythrozytären Stadien.
Die Aminosäuren Cystein, Methionin und Glutamin sind im menschlichen Hämoglobin nur spärlich, Isoleucin gar nicht vorhanden und müssen deshalb durch den Parasiten anderweitig beschafft werden. Die Durchlässigkeit der Membran infizierter Erythrozyten für Aminosäuren und andere Komponenten nimmt dann auch im Verlauf einer Infektion zu. [Sherman, 1998, S. 145-146]
Zurück zur Orientierung "Lebenszyklus"
Nach einigen Zyklen der asexuellen Merozoiten-Schizonten-Vermehrung entstehen innerhalb der Erythrozyten, während der sogenannten Gametozytogenesis aus den Merozoiten sexuelle Formen des Parasiten. Dabei findet eine Entwicklung über ein Trophozoitenstadium hin zu den geschlechtlichen Formen statt. Nach J. INSELBURG entsteht bei Plasmodium falciparum ein Schizont, der sich entweder entweder in Merozoiten aufspaltet, also ein Blutschizont, oder aber sowohl Gametozyten als auch Merozoiten bildet. Ausserdem werden bei Plasmodium falciparum männliche Mikrogametozyten und weibliche Makrogametozyten normalerweise im Verhältnis von 1 : 8 gebildet. Dadurch wird ein Gleichgewicht erreicht, denn aus einem Mikrogametozyten entstehen später acht Mikrogameten. [WHO, 1987, S. 35]
Wahrscheinlich wir die Entscheidung, ob sich ein Merozoit zu einer weiblichen oder männlichen Geschlechtsform entwickelt, bereits im Stadium vor dem Eindringen in einen Erythrozyten gefällt. Für den Übergang von den asexuellen zu den sexuellen Stadien sind aber eine ganze Reihe von inneren und äusseren Faktoren verantwortlich.
In Kulturen konnte gezeigt werden, dass unmittelbar aus dem Leberschizonten gewonnene Merozoiten die grösste Tendenz zu einer geschlechtlichen Entwicklung aufweisen, während die Parasitengenerationen der folgenden asexuellen Vermehrungsfolgen diese zunehmend verlieren. Dieses Phänomen korreliert mit einer zunehmenden Häufung von chromosomalen Brüchen und Neuzusammensetzungen.
Zu den äusseren Faktoren, welche die Gametozytogenesis begünstigen gehören immunologischer Stress, d.h. die Reaktion des Wirtes auf den Parasiten, und die Chemotherapie. Es gibt Anzeichen dafür, dass sublethale Dosen von Chloroquin, wie sie etwa bei einer abgebrochenen Behandlung oder einer nicht konsequent durchgeführten Chemoprophylaxe auftreten können, in einer Zunahme der Gametozytogenesis, insbesonders bei chloroquinresistenten Parasiten, resultieren. Sulfadiazin und Sulfamethazin könnten für eine verlängerte Periode hoher Gametozytogenesis verantwortlich sein.
Auch das Alter des Erythrozyten scheint einen Einfluss zu haben: So wurden mehr Gametozyten in Retikulozyten als in Normozyten gefunden. Dies könnte jedoch auch auf die vom Parasiten für die Gametozytogenesis benötigte Entwicklungszeit und die unterschiedliche Lebensdauer zwischen den weniger lang lebenden Normozyten und den Retikulozyten zurückzuführen sein. [Sherman, 1998, S. 26-27]
Zurück zur Orientierung "Lebenszyklus"
Mit Plasmodium falciparum-Gamtozyten infizierte Erythrozyten durchlaufen einen Teil ihrer Reifung ausserhalb des peripheren Blutstromes. Die von jungen Gametozyten befallenen Erythrozyten finden sich in den Tiefengeweben des Körpers und treten erst nach ihrer Reifung, d.h. je nach Temperatur bereits nach etwa 10 Tagen wieder in Erscheinung. Während den nächsten beiden Tagen zirkuliert der infizierte Erythrozyt im peripheren Blut und gewinnt zunehmend an Infektivität gegenüber Anophelesmücken. Insgesamt können bei Plasmodium falciparum fünf Stadien der Reifung unterschieden werden, deren unterschiedliche Formen auf die Entwicklung der inneren Strukturen, vor allem der Vakuole und der Mikrotubuli unter der Plasmamembran, zurückzuführen sind. [WHO, 1987, S. 39]
Stadium 1: Während der ersten beiden Tages der sexuellen Entwicklung zeigt der sich in den Erythrozyten der tieferen Gewebe befindende Parasit eine rundliche Form. Er ist von einer einzigen Plasmamembran umgeben und besitzt einen kleinen Zellkern.
Stadium 2: Nach einem bis vier Tagen ändert der Parasit seine Form und erscheint nun D-förmig. Gleichzeitig sind 8-15 Mikrotubuli und einer innere Membranvakuole auf der geraden Seite der Zelle zu erkennen. Der Zellkern formt einige Spindeln aus.
Stadium 3: Nach zwei bis acht Tagen zeigt sich eine deutliche Störung des parasitierten Erythrozyten. Im Innern des Parasiten sind 15-40 Mikrotubuli zu erkennen und die innere Vakuolenmembran umfasst nun fast den gesamten Innenraum. Der Kern des weiblichen Gametozyten ist in diesem Stadium deutlich kleiner als der des männlichen, welcher verschiedene Ausbuchtungen zeigen. Im weiblichen Gametozyten kommt es ausserdem zu einer Vermehrung der Mitochondrien.
Stadium 4: Nach sechs bis zehn Tagen nimmt der Gametozyt Spindelform an. Die Mikrotubuli und die Vakuolenmembran umfassen nun den gesamten Zellraum. Der Zellkern des weiblichen Gametozyten erscheint klein, derjenige des männlichen gross. Sowohl weiblicher als auch männlicher Gametozyt weisen eine hohe Ribosomendichte auf, ausserdem besitzt die weibliche Geschlechtsform des Parasiten zahlreiche, die männliche nur wenige Mitochondrien und osmiophile Körperchen.
Stadium 5: Nach einem Zeitraum von neun bis 23 Tagen gelangen die parasitierten Erythrozyten in die periphere Blutzirkulation. Der Parasit zeigt nun die bereits von Ross beschriebene Halbmondform, während die verformten Erythrozyten sogenannte "Garnham Körperchen" enthalten können. Die Mikrotubuli sind depolymerisiert, die innere Membran bleibt erhalten. Während der weibliche Zellkern keine neuen Merkmale aufweist, zeigt der männliche zahlreiche Ausbuchtungen mit zwischenzellkernigen Körperchen. Im Zellplasma des männlichen Gametozyten lässt sich eine dramatische Reduktion der Ribosomen beobachten, während sowohl weibliche als auch männliche Erreger Pigmentkonzentrationen um den Zellkern herum aufweisen. [Sherman, 1998, S. 28].
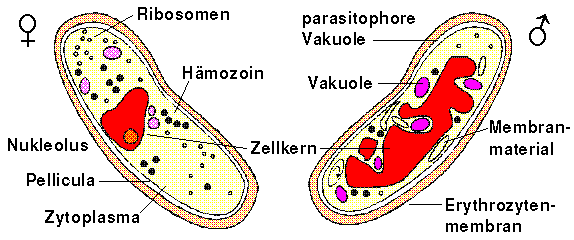
Weiblicher (links) und männlicher (rechts) Gametozyt [nach
Brown]
Zurück zur Orientierung "Lebenszyklus"
Bei den meisten Plasmodienarten dauert die Gametozytogenesis 110-200% länger als die asexuelle Entwicklung. Bei Plasmodium falciparum fällt die Periode der Gametozytogenesis aber wesentlich länger aus und dauert zwischen 9 bis 12 Tagen, während die asexuelle Entwicklung 43-48 Stunden beansprucht. Dadurch unterscheidet sich Plasmodium falciparum wesentlich von anderen Malariaerregern im Mensch, Säugetier, Vögeln und Reptilien.
Morphologisch gleichen die unreifen Gametozyten der meisten Malariaparasiten in Säugetieren den Trophozoiten und können von diesen erst nachdem sie 80 - 90% der gametozytalen Entwicklung durchlaufen haben, unterschieden werden. In Plasmodium falciparum ist eine Unterscheidung schon nach 10 - 25% der sexuellen Entwicklung möglich.
Unreife Gametozyten von Plasmodium falciparum sequestrieren in den Tiefengeweben des Körpers, besonders im Knochenmark. Von dieser Sequestrierung kann Plasmodium falciparum aufgrund der langen Reifungszeit profitieren, da sie ein mehrmaliges Passieren und allfälliges Ausfiltern der infizierten Erythrozyten durch die Milz und anderes phagozytotisches Gewebe, vermeidet. [Sherman, 1998, S. 27]
Zurück zur Orientierung "Lebenszyklus"
Die reifen Gametozyten scheinen im G0-Stadium des Zellzyklus zu verharren, woraus sich ergibt, dass sie von einer Mehrheit der Antimalariamedikamente, welche nur auf die aktive Phase der Zellreplikation einwirken, nicht abgetötet werden. — Eine Ausnahme bilden die 8-Aminoquinoline (z. B. Primaquin) und andere Stoffe, welche die Energieproduktion in den Mitochondrien oder den Plastiden der Erreger blockieren. — Aus diesem Grund bleibt die Mehrheit der Gametozytenpopulation eines mit den üblichen Schizontozoiziden (z. B. Chloroquin) behandelten Patienten für blutsaugende Anophelesmücke infektiös. Die reifen Gametozytenpopulationen von Plasmodium falciparum weisen zum Beispiel eine Halbwertzeit von zweieinhalb Tagen auf und liegen auch noch nach 22 Tagen in genügend hoher Individuenzahl vor, um die Infektion einer Stechmücke zu ermöglichen. [Sherman, 1998, S. 29-30] Bei Plasmodium vivax überleben die Gametozyten hingegen nur einen einzigen Tag. [Kayser, 1998, S. 534]
Zurück zur Orientierung "Lebenszyklus"
Die Entwicklung der Malariaparasiten im Überblick dient dazu, nach den detaillierten Angaben den Malariazyklus noch einmal in seinen Grundzügen zu betrachten. Die Tabelle zur Entwicklung der Malariaparasiten gibt einen kurzen Überblick über die wichtigsten Stadien und deren Bedeutung für den Parasiten.
Zurück zur Orientierung "Lebenszyklus"
Die komplexe Entwicklung der Malariaparasiten kann in zwei grosse Entwicklungsschritte, die zahlreiche Zwischenstufen beinhalten, eingeteilt werden: Die Entwicklung in der Stechmücke (Vektor und Endwirt), die der sexuellen Reproduktion des Parasiten dient, und die Entwicklung im Menschen (Zwischenwirt), die ein notwendiges Bindeglied in der Neuinfektion des Endwirtes darstellt.
Zurück zur Orientierung "Lebenszyklus"
Eine Stechmücke der Gattung Anopheles kann sich beim Blutsaugen an einem von Malaria befallenen Menschen mit dem Parasiten, der in der Form eines Gametozyten in einem Erythrozyten ruht, infizieren. Durch den vom Übergang auf die Stechmücke ausgelösten Temperatursturz und weiteren Faktoren entwickelt sich der Parasit in der sogenannten Gametogenesis zu männlichen und weiblichen Geschlechtszellen, die aus den sie bisher umringenden Wirtszellen ausbrechen.
Während die weiblichen Geschlechtszellen, die Makrogameten, sich kaum verändern, teilt sich der männliche Mikrogamet, in einem als Exflagellation bezeichnetet Prozess in zahlreiche Flagellaten, die als "Spermien" des Malariaparasiten angesehen werden können. Durch die Vereinigung eines Flagellaten mit einem Makrogameten entsteht eine befruchtete Eizelle, die Zygote, die sich in einen in das Darmgewebe der Anophelesmücke eindringenden Ookineten verwandelt.
Der Ookinet nistet sich in den das Darmgewebe begrenzenden Epithelzellen ein und formt sich zur Oozyste um, die in ihrem Innern zahlreiche Sporozoiten produziert, die durch das Zerplatzen des Oozysten schliesslich in den Hämolymphe der Anophelesmücke gelangen.
Einmal freigesetzt beginnen die Sporozoiten ihre Wanderung zu den Speicheldrüsen der Anophelesmücke, wo sie sich in der Speichelkanüle ansammeln und beim Blutsaugen des Vektors auf den Menschen übertragen werden.
Der von der Anophelesmücke in den Blutkreislauf des Menschen eingebrachte Sporozoit gelangt durch den Blutkreislauf in die Leber, wo er unter noch nicht vollständig geklärten Umständen in die Hepatozyten der Leber eindringt.
In den Leberzellen gewinnt der sogenannte Leberschizont zunehmend an Grösse und entlässt nach mehreren Teilungsphasen, zahlreiche als Merozoiten bezeichnete, Parasitenformen in den Blutkreislauf. Beim Kontakt ihrer von Proteinfäden bedeckten Oberflächen mit der Oberfläche des Erythrozyten, bleiben die Merozoiten, ähnlich einer Klette, an den roten Blutkörperchen hängen und dringen in diese ein, wo sie sich in Trophozoiten verwandeln.
Der Trophozoit ernährt sich, innerhalb des Erythrozyten in einer Vakuole liegend, von der im Blutstrom vorhandenen Glucose, die er zu Laktat fermentiert, und dem aus dem Erythrozyten stammenden Hämoglobin, welches er zur Aminosäuregewinnung in die Einzelbestandteile abbaut. Das dabei freigesetzte, für den Parasiten giftige Häm, bindet der Trophozoit im Hämozoin, das unter dem Mikroskop als Malariapigment erkennbar ist.
Schliesslich entwickelt sich der Trophozoit in den sogenannten Blutschizonten, der ähnlich dem Leberschizonten, nach mehrmaligen Kernteilungen zahlreiche Merozoiten in den Blutstrom entlässt, die dann weitere Erythrozyten befallen können.
Nach einigen Vermehrungszyklen über den Merozoiten-Trophozoiten-Blutschizonten Mechanismus, entstehen aus den Merozoiten aus bisher nicht bekannten Gründen, in der sogenannten Gametozytogenesis, Geschlechtszellen, die von der Anophelesmücke beim Blutsaugen aufgenommen werden können, und in der Lage sind diese zu infizieren und einen neuen Infektionszyklus zu beginnen.
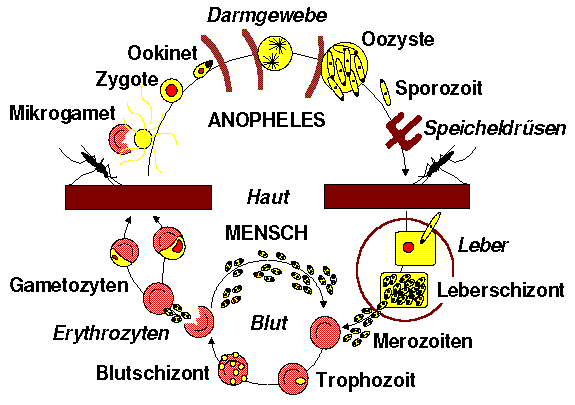
Lebenszyklus von Plasmodium falciparum [nach OptiMAL]
Zurück zur Orientierung "Lebenszyklus"
Die nachfolgende Tabelle zeigt für jedes Stadium der jeweiligen Entwicklungsform deren Funkton, deren Aufenthaltsort und deren Genom an. In der Tabelle werden die folgenden Abkürzungen verwendet: M = Mensch, V = Vektor (Anophelesmücke); s = sexuelle Entwicklungsphase, a = asexuelle Entwicklungsphase; h = haploides Genom, d = diploides Genom.
| Stadium | Funktion | Aufenthaltsort | Weiterentwicklung zu | Sonstiges |
|---|---|---|---|---|
| Makro- und Mikrogameten | Befruchtung | Blutmahlzeit | Zygote | V, s, h |
| Zygote | Neukombination des Genmaterials | Blutmahlzeit | Ookinet | V, s, d |
| Ookinet | Wanderung | Blutmahlzeit - Darmzellen | Oozyste | V, s, h |
| Oozyste | Vermehrung | Darmzellen | Sporozoit | V, a, h |
| Sporozoit | Wanderung | Hämolymphe - Speicheldrüsen - Leber | Leberschizont | V/M, a, h |
| Leberschizont | Vermehrung | Leberzellen | Merozoit | M, a, h |
| Merozoit | Wanderung | Blutkreislauf | Trophozoit oder Gametozyt | M, a, h |
| Trophozoit | Wachstum | Erythrozyt | Blutschizont | M, a, h |
| Blutschizont | Vermehrung | Erythrozyt | Merozoit | M, a, h |
| Gametozyt | Transport | Erythrozyt | Gameten | M/V, s, h |
Zurück zur Orientierung "Lebenszyklus"
Die drei an der menschlichen Malaria beteiligten Organismen, die Malariaerreger, die Anophelesmücke und der Mensch selbst leben in Welten unterschiedlicher Grössenordnung. Für den Menschen ist die rund 50 - 100 mal kleinere Anophelesmücke zwar noch gut erkennbar, ihr Ei und das erste Larvenstadium bewegen sich jedoch bereits an der natürlichen Sichtgrenze des Menschen. Noch einmal rund 10 - 1000 mal kleiner als die Anophelesmücke sind die verschiedenen Stadien der Malariaerreger. Ein Merozoit misst nur noch gerade 2 -3 µm, ist also rund 100 mal kleiner als eine menschliche Eizelle. Der Leberschizont kann eine Grösse von etwa 50 µm erreichen und ist damit wesentlich grösser als die nur gerade rund 7 µm messenden roten Blutkörperchen des Menschen. Und die auf dem Darmgewebe der Anophelesmücke wachsende Oozyste soll sogar einen Durchmesser von bis zu 500 µm, also einem halben Millimeter, erreichen und hat damit eine den Anopheleseiern vergleichbare Grösse.
Grössenvergleich der einzelnen Organismen
Zurück zur Orientierung "Lebenszyklus"
|
|
|
|
|---|
Fragen, Anregungen oder Korrekturanmerkungen an mattgig@freesurf.ch sind willkommen.
Matthias Giger, Oktober 1999 (Update: 31.01.2002)